 ЗФТШ
ЗФТШ
- Обучение
- Поступление в ЗФТШ
- О ЗФТШ
- Учителям
- Лекторий
-
Курсы
- Заочное отделение
- Очное отделение
- Факультативы

Для того, чтобы уметь определять степени окисления атомов в соединениях, нужно знать следующие правила:
степень окисления атомов в простом веществе равна $$ 0$$.
Есть элементы, атомы которых проявляют постоянные степени окисления (вы поймете почему, если вспомните строение их валентного уровня и учтете размер их атомов):
фтор: $$ -1$$
кислород: $$ -2$$ (есть исключения: $$ {\mathrm{O}}^{+2}{\mathrm{F}}_{2}$$, пероксиды и надпероксиды);
все щелочные металлы ($$ \mathrm{IA}$$-подгруппа): $$ +1$$;
все элементы $$ \mathrm{II}$$ группы (кроме $$ \mathrm{Hg}$$): $$ +2$$;
алюминий: $$ +3$$; водород с металлами: $$ -1$$, с неметаллами: $$ +1$$.
Все остальные элементы проявляют переменные степени окисления. Например, сера - может принять $$ 2$$ электрона и проявить отрицательную степень окисления $$( -2)$$, или отдать $$ 2, 4$$ или все `6` электронов со своего внешнего уровня, и проявить, соответственно, степень окисления $$ +2,+4$$ или $$ +6$$.
$$ {}_{16}\mathrm{S} 1{s}^{2}2{s}^{2}2{p}^{6}\underline{3{s}^{2}3{p}^{4}}$$ или $$ \left[\mathrm{Ne}\right]\underline{3{s}^{2}3{p}^{4}}\to +2{\mathrm{e}}^{-}\to {}_{16}\mathrm{S}^{2-}1{s}^{2}2{s}^{2}2{p}^{6}\underline{)3{s}^{2}3{p}^{6}}$$ или `["Ar"]`
$$ {}_{16}\mathrm{S}\left[\mathrm{Ne}\right]\underline{3{s}^{2}3{p}^{4}}\to -2{\mathrm{e}}^{-}\to {}_{16}\mathrm{S}^{2+}1{s}^{2}2{s}^{2}2{p}^{6}\underline{3{s}^{2}3{p}^{6}}$$ или `["Ne"]ul(3s^2 3p^2)`
$$ {}_{16}\mathrm{S}\left[\mathrm{Ne}\right]\underline{3{s}^{2}3{p}^{4}}\to -4{\mathrm{e}}^{-}\to {}_{16}\mathrm{S}^{4+}1{s}^{2}2{s}^{2}2{p}^{6}\underline{3{s}^{2}}$$ или `["Ne"]ul(3s^2)`
$$ {}_{16}\mathrm{S}\left[\mathrm{Ne}\right]\underline{3{s}^{2}3{p}^{4}}\to -6{\mathrm{e}}^{-}\to {}_{16}\mathrm{S}^{6+}1{s}^{2}2{s}^{2}2{p}^{6}$$ или `["Ne"]`.
Для элементов главных подгрупп работает правило «чётностинечётности»: элементы главных подгрупп чётных групп проявляют, как правило, чётные степени окисления, нечетных групп - нечётные.
Высшее значение степени окисления элемента (высшая степень окисления) обычно равно номеру группы. Например,
$$ {}_{6}\mathrm{C}$$ - в $$ \mathrm{IV}$$ группе - высшая степень окисления $$ +4$$
$$ {}_{15}\mathrm{P}$$ - в $$ \mathrm{V}$$ группе - высшая степень $$ +5$$
$$ {}_{17}\mathrm{Cl}$$ - в $$ \mathrm{VII}$$ группе - высшая степень $$ +7$$.
Исключения:
кислород - хоть и в $$ \mathrm{VI}$$ группе, но степень окисления $$ +6$$ никогда не проявляет;
фтор - как уже говорилось, кроме нулевой, проявляет единственную степень окисления $$ (–1)$$;
благородные газы;
элементы $$ \mathrm{VIII} \mathrm{B}$$ подгруппы - только для $$ \mathrm{Os}$$ и $$ \mathrm{Ru}$$ характерна степень окисления $$ +8$$.
Низшее значение степени окисления для металлов равно $$ 0$$, для неметаллов $$ \mathrm{V},\mathrm{VI},\mathrm{VII}$$ групп и углерода: $$ №$$ группы минус `8`.
Например, для $$ {}_{15}\mathrm{Р}:V-8=-3$$,
для $$ {}_{35}\mathrm{Br}:\mathrm{VII}-8=-1$$,
для $$ {}_{34}\mathrm{Se}:\mathrm{VI}-8=-2$$,
для $$ {}_{56}\mathrm{Ba}=0$$.
Исключение - бор, водород и благородные газы.
Сумма степеней окисления всех атомов в соединении равна `0`, в ионе - заряду этого иона.
В бинарных соединениях (то есть в соединениях, состоящих из атомов двух разных элементов) степень окисления у атомов с большей электроотрицательностью отрицательна, а с меньшей - положительна.
Так, в молекуле аммиака $$ {\mathrm{NH}}_{3}$$ ОЭО $$ \left(\mathrm{N}\right)=\mathrm{3,04}$$, а водорода равна $$ \mathrm{2,20}$$. Следовательно, азот проявляет отрицательную степень $$ (-3)$$, а водород - положительную $$ (+1)$$.
Металлы в соединениях с неметаллами никогда не проявляют отрицательных степеней окисления - они все электроположительнее неметаллов!

Контрольные задания (I часть)
Строение атома и ПСХЭ
1(10). Ответьте на вопросы:
а) сколько значений магнитного квантового числа возможно для электро-нов энергетического подуровня, орбитальное квантовое число которого ? б) укажите порядковый номер элемента, у которого заканчивается заполне-ние электронами орбиталей 5d-подуровня.
в) какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом ?
г) сколько вакантных 4d-орбиталей имеет атом селена во втором возбуждённом состоянии?
д) у какого элемента подуровень 4f заполнен электронами наполовину?
е) перечислите электронные аналоги элемента ниобия .
ж) Справедливо ли утверждение: в атомах щёлочноземельных металлов имеется завершённый – подуровень?
з) у элементов каких периодов электроны внешнего слоя характеризуются значением ?
и) Электронная конфигурация атома . Какой это эле-мент?
к) укажите два противоположно заряженных иона, чья электронная конфигурация соответствует конфигурации благородного газа неона.
2(5). Изобразите электронные конфигурации и электронные диаграммы валентного уровня атомов мышьяка, хрома, платины, кобальта, стронция.
3(3). Руководствуясь правилами заполнения электронами энергетических уровней и подуровней, запишите электронные конфигурации электроней-тральных атомов по заданным конфигурациям ионов:
а)
б)
в)
г) Укажите символы и названия элементов, для которых приведены электронные конфигурации.
4(1). Расположите элементы в порядке:
а) увеличения радиуса;
б) уменьшения металлических свойств;
в) уменьшения окислительных свойств;
г) увеличения электроотрицательности:
5(1). На каком основании кадмий и бериллий, йод и марганец расположены в одной группе Периодической системы? Почему их помещают в разные подгруппы?

Изучение природы химической связи между частицами вещества в соединении - одна из основных задач химии. Не зная природу взаимодействия атомов в веществе, нельзя понять причины многообразия химических соединений, представить механизм их образования, состав, строение и реакционную способность.
Совокупность химически связанных атомов (например, молекула, кристалл) представляет собой сложную систему атомных ядер и электронов.
Химическая связь осуществляется за счёт электростатического взаимодействия электронов и ядер атомов.
Современные методы исследования позволяют экспериментально определить пространственное расположение атомных ядер в веществе. Данному пространственному размещению атомных ядер отвечает определенное распределение электронной плотности. Выяснить, как распределяется электронная плотность, по сути дела, и означает описать химическую связь в веществе.
В зависимости от характера распределения электронной плотности в веществе различают три основных типа химической связи: ковалентную, ионную и металлическую. В "чистом" виде перечисленные типы связи проявляются редко. В большинстве соединений имеет место наложение разных типов связи.
Важнейшей характеристикой химической связи является энергия, определяющая её прочность. Мерой прочности связи может служить количество энергии, затрачиваемое на ее разрыв. Для двухатомных молекул энергия связи равна энергии диссоциации молекул на атомы. `"E"_"дис"`, а следовательно, и энергия связи `"E"_"св"` в молекуле $$ {\mathrm{H}}_{2}$$ составляют $$ 435$$ кДж/моль. В молекуле фтора $$ {\mathrm{F}}_{2}$$ она равна $$ 159$$ кДж/моль, а в молекуле азота $$ {\mathrm{N}}_{2}$$- $$ 940$$ кДж/моль.
Энергия связи напрямую коррелирует с длиной связи.
это межъядерное расстояние между химически связанными атомами. Она зависит от радиуса образующих связь атомов и от кратности самой связи.
Угол между воображаемыми линиями, проходящими через ядра химически связанных атомов, называют валентным.
Химическая связь в основном осуществляется так называемыми валентными электронами. У `s`- и `p`-элементов валентными являются электроны `s`- и `p`-орбиталей внешнего слоя, у `d`-элементов - электроны `s`-орбиталей внешнего слоя и `d`-орбиталей предвнешнего слоя, а у `f`-элементов − электроны `s`-орбиталей внешнего слоя и `f`-орбиталей предпредвнешнего слоя.

Взаимодействие валентных (наименее прочно связанных с ядром) электронов атомов приводит к образованию химических связей, т. е. к объединению атомов в молекулу. Образование молекулы из атомов возможно лишь тогда, когда оно приводит к выигрышу энергии; молекулярное состояние должно обладать меньшей энергией, чем атомное состояние, и, следовательно, быть устойчивее. Таким наиболее устойчивым является состояние атома, когда число электронов на внешнем электронном уровне максимальное, которое он может вместить; такой уровень называется завершенным и характеризуется наибольшей прочностью. Таковы электронные конфигурации атомов благородных газов. Значит, образование химической связи должно приводить к завершению внешнего электронного уровня атомов.
Это взаимодействие валентных электронов, приводящее к образованию химической связи, может осуществляться по-разному. Различают три основных вида химической связи: ковалентную, ионную и металлическую.
Рассмотрим механизм возникновения ковалентной связи на примере образования молекулы водорода (рис. 3):
`"H" + "H" = "H"_2`; `Delta"H"=-436` кДж/моль
Реакция сопровождается высвобождением большого количества тепла, значит, она энергетически выгодна.
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным `1s`-электроном. При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей).
Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов.
Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры соединяющихся атомов, называется `sigma`-связью.
1) в виде точек, обозначающих электроны и поставленных у химического знака элемента:
$$ \mathrm{H}·+·\mathrm{H}=\mathrm{H}:\mathrm{H}$$ где «`:`» означает `sigma`-связь;
2) с помощью квантовых ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке:
3) часто, особенно в органической химии, ковалентную связь изображают черточкой, которая символизирует пару электронов: `"H"-"H"`.
Ковалентная связь в молекуле хлора также осуществляется с помощью двух общих электронов или электронной пары:
$$ :\underset{··}{\overset{··}{\mathrm{Cl}}}·+·\underset{··}{\overset{··}{\mathrm{Cl}}}:\to :\underset{··}{\overset{··}{\mathrm{Cl}}}:\underset{··}{\overset{··}{\mathrm{Cl}}}:$$
В каждом атоме хлора `7` валентных электронов, из них `6` в виде неподеленных пар, а `1` - неспаренный электрон. Образование химической связи происходит именно за счёт неспаренных электронов каждого атома хлора. Они связываются в общую пару (или неподелённую пару) электронов. Если считать, что общая пара принадлежит обоим атомам, то каждый из них становится обладателем `8` электронов, т. е. приобретает устойчивую конфигурацию благородного газа. Поэтому ясно, что молекула хлора энергетически выгоднее, чем отдельные атомы.
неподелённые пары остаются при своих атомах, а та что их связывает уже становится поделённой между двумя атомными центрами.
Это также `sigma`-связь, но она образована перекрыванием `p`-электронных орбиталей по оси `x` (рис. 4).
Если в реагирующих атомах имеется $$ 2$$ или $$ 3$$ неспаренных электрона, то могут образоваться не $$ 1$$, а $$ 2$$ или $$ 3$$ связи, т. е. общие электронные пары. Если между атомами возникла одна ковалентная связь, то она называется одинарной, если две -двойной, если три - тройной. Они обозначаются соответственно «`=`» или «`-=`» штрихами.
Но хотя обозначение их одинаково, они отличаются по своим свойствам от одинарной `sigma`-связи. Чтобы пояснить разницу, рассмотрим образование тройной связи в молекуле азота `"N"_2`. В ней атомы имеют три общие пары электронов:
$$ :\underset{·}{\overset{·}{\mathrm{N}}}·+·\underset{·}{\overset{·}{\mathrm{N}}}:\to \stackrel{··}{\mathrm{N}}⋮⋮\stackrel{··}{\mathrm{N}}$$
Они образованы неспаренными `p`-электронами двух атомов азота:
Орбитали `2p`-электронов расположены взаимно перпендикулярно, т. е. по осям `x`, `y` и `z`. Если перекрывание по оси `x` ведёт к образованию `σ`-связи (перекрывание вдоль линии, связывающей центры атомов), то перекрывание по осям `y` и `z` происходит по обе стороны от линии, связывающей центры соединяющихся атомов. Такая ковалентная связь, возникающая при перекрывании орбиталей по обе стороны от линии, связывающей центры соединяющихся атомов, называется `pi`-связью.
Очевидно, что взаимное перекрывание орбиталей в случае `pi`-связи меньше, чем в случае `sigma`-связи, поэтому `pi`-связь всегда менее прочная, чем `sigma`-связь. Но в сумме три связи `(sigma_x+pi_y+pi_z)` придают молекуле $$ {\mathrm{N}}_{2}$$ большую прочность (рис. 5), поэтому молекула азота при нормальных условиях нереакционноспособна.
Таким образом, если имеется ординарная связь, то это обязательно `sigma`-связь; если имеется двойная или тройная связь, то одна из составляющих её связей обязательно `sigma`-связь (как более прочная она формируется первая и разрушается последняя), а остальные -`pi`-связи. И `sigma`-, и `pi`-связи – это разновидности ковалентной связи.
В общем случае ковалентной называется химическая связь, осуществляемая электронными парами.
Различают неполярную и полярную ковалентную связь. Все рассмотренные выше молекулы образованы атомами одного и того же элемента, при этом двухэлектронное облако связи распределяется в пространстве симметрично относительно ядер обоих атомов, и электронная пара в одинаковой мере принадлежит обоим атомам. Такая связь называется неполярной ковалентной связью.
Иной случай реализуется, если связь образуют два атома различных элементов с отличающимися величинами относительной электроотрицательно-сти, например $$ \mathrm{HCl}$$, $$ {\mathrm{H}}_{2}\mathrm{O}$$, $$ {\mathrm{H}}_{2}\mathrm{S}$$, $$ {\mathrm{NH}}_{3}$$ и др. В этом случае электронное облако связи смещено к атому с большей относительной электроотрицательностью. Такой вид связи называется полярной ковалентной связью.
Например, полярная ковалентная связь образуется при взаимодействии атомов водорода и хлора (рис. 6).
$$ \mathrm{H}·+·\underset{··}{\overset{··}{\mathrm{Cl}}}:\to \mathrm{H}:\underset{··}{\overset{··}{\mathrm{Cl}}}:$$
Электронная пара смещена к атому хлора, так как относительная электроотрицательность хлора `(x=3)` больше, чем у водорода `(x=2,1)`.
У молекул, содержащих неполярную связь, связующее облако распределяется симметрично между ядрами обоих атомов, и ядра в равной степени тянут его к себе. Электрический момент диполя таких молекул $$( {\mathrm{H}}_{2},{\mathrm{F}}_{2},{\mathrm{Cl}}_{2}$$ и др.`)` равен нулю. Молекулы, содержащие полярную связь, образованы связующим электронным облаком, смещенным в сторону атома с большей относительной электроотрицательностью.
Описанные выше примеры образования ковалентной связи относятся к обменному механизму, когда каждый из соединяющихся в молекулу атомов предоставляет по электрону. Однако образование ковалентной связи может происходить и по донорно-акцепторному механизму. В этом случае химическая связь возникает за счёт двухэлектронного облака одного атома (спаренных электронов) и свободной орбитали другого атома. Атом, предоставляющий неподеленную пару, называется донором, а атом, принимающий её (т. е. предоставляющий свободную орбиталь) – акцептором.
Механизм образования ковалентной связи за счёт двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным; образованная таким путём ковалентная связь называется донорно-акцепторной или координационной связью.
Рассмотрим в качестве примера механизм образования иона $$ {\mathrm{NH}}^{4+}$$. В молекуле аммиака атом азота имеет неподеленную пару электронов; у иона водорода свободна `1s`-орбиталь. При образовании катиона аммония двухэлектронное облако азота становится общим для атомов $$ \mathrm{N}$$ и $$ \mathrm{H}$$, т. е. оно превращается в молекулярное электронное облако. Таким образом, возникает четвертая ковалентная связь:
Положительный заряд иона водорода становится общим (он рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежавшее азоту, становится общим с водородом. По своим свойствам четвертая $$ \mathrm{N}-\mathrm{H}$$ связь в ионе $$ {\mathrm{NH}}_{4}^{+}$$ ничем не отличается от остальных трех. Поэтому донорно-акцепторная связь - это не особый вид связи, а лишь особый механизм (способ) образования ковалентной связи.
Еще один тип связи - ионная связь - возникает, когда взаимодействуют электронные облака атомов, чьи относительные электроотрицательности резко отличаются. В этом случае общая электронная пара настолько смещена к одному из атомов, что практически переходит в его владение. При этом он образует отрицательно заряженный анион, а атом, отдавший электрон - катион. Например, атомы натрия и хлора резко отличаются по электроотрицательности (`x=0,9` и `x=3` соответственно), поэтому атом хлора очень сильно притягивает электрон, стремясь завершить свой внешний электронный уровень, а атом натрия охотно его отдаёт, поскольку ему для получения устойчивой конфигурации внешнего слоя удобнее отдать единственный валентный электрон:
$$ \mathrm{Na}\left(1{s}^{2}2{s}^{2}2{p}^{6}3{s}^{1}\right)–е={\mathrm{Na}}^{+}\left(1{s}^{2}2{s}^{2}2{p}^{6}\right)$$
$$ \mathrm{Cl}\left(1{s}^{2}2{s}^{2}2{p}^{6}3{s}^{2}3{p}^{5}\right)+е={\mathrm{Cl}}^{-}\left(1{s}^{2}2{s}^{2}2{p}^{6}3{s}^{2}3{p}^{6}\right)$$.
Электронная оболочка атома натрия превратилась в устойчивую оболочку атома неона, а оболочка хлора - в устойчивую оболочку другого инертного газа - аргона. Между ионами $$ {\mathrm{Na}}^{+}$$ и $$ {\mathrm{Cl}}^{-}$$, несущими разноименные заряды, возникают силы электростатического притяжения, в результате чего образуется соединение $$ \mathrm{NaCl}$$.
Химическая связь между ионами, возникающая в результате их электростатического притяжения, называется ионной связью.
Ионные соединения образуют атомы элементов, резко отличающихся по электроотрицательности, например атомы элементов главных подгрупп $$ \mathrm{I}$$ и $$ \mathrm{II}$$ и групп с элементами главных подгрупп $$ \mathrm{VI}$$ и $$ \mathrm{VII}$$ групп.
Таким образом, между механизмами возникновения ковалентной и ионной связей нет принципиального различия. Они различаются лишь степенью поляризации (смещения) общих электронных пар. Поэтому можно рассматривать ионную связь как предельный случай полярной ковалентной связи.
Вместе с тем надо помнить о важных отличиях ионной связи от ковалентной. Ионная связь характеризуется ненаправленностью в пространстве (каждый ион может притягивать ион противоположного знака по любому направлению) и ненасыщаемостью (взаимодействие ионов не устраняет способность притягивать или отталкивать другие ионы). Вследствие ненаправленности и ненасыщаемости ионные соединения в твёрдом состоянии представляют собой ионную кристаллическую решётку, в которой каждый ион взаимодействует не с одним, а со многими ионами противоположного знака; например, в решётке хлорида натрия катион натрия окружён шестью хлорид-анионами и наоборот. Связи между ионами многочисленны и прочны, поэтому вещества с ионной решёткой тугоплавки, малолетучи и обладают сравнительно высокой твёрдостью. При плавлении ионных кристаллов прочность связи между ионами уменьшается, и расплавы их проводят электрический ток. Ионные соединения, как правило, хорошо растворяются в воде и других полярных растворителях.
В то же время ковалентная связь отличается насыщаемостью (т. е. способностью атомов образовывать ограниченное количество ковалентных связей, определяемое числом неспаренных электронов) и направленностью (определённой пространственной структурой молекул, которой мы коснёмся ниже).
Твёрдые вещества, состоящие из молекул (полярных и неполярных), образуют молекулярные кристаллические решётки. Молекулы в таких решётках соединены сравнительно слабыми межмолекулярными силами, поэтому вещества с молекулярной решёткой имеют малую твёрдость, низкие температуры плавления, они плохо растворимы в воде, а их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной кристаллической решёткой невелико: лёд, твёрдый оксид углерода `("IV")` («сухой лёд»), твёрдые галогеноводороды и простые вещества, но зато большинство кристаллических органических соединений имеют молекулярную решётку.
Если же в узлах решётки располагаются атомы, соединённые прочными ковалентными связями, то такие вещества имеют высокие температуры плавления, прочность и твёрдость, они практически нерастворимы в жидкостях.
Характерный пример вещества с атомной кристаллической решёткой - алмаз; она характерна также для твёрдого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Особый тип решётки в твёрдом состоянии образуют металлы. В узлах такой металлической кристаллической решётки находятся катионы металлов, а между ними - отрицательно заряженный «электронный газ». Атомы металлов в решётке упакованы так тесно, что валентные орбитали соседних атомов перекрываются, и электроны получают возможность свободно перемещаться из орбиталей одного атома в орбитали других атомов, осуществляя связь между всеми атомами данного кристалла металла. Лишённые валентных электронов, атомы превращаются в катионы, а электроны, осуществляющие связь, перемещаются по всему кристаллу металла и становятся общими.
Такой тип химической связи, которая осуществляется электронами, принадлежащими всем атомам одновременно, называется металлической связью. Металлическая связь характерна для металлов в твёрдом и жидком состоянии.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку и в ее основе лежит обобществление валентных электронов. Однако при ковалентной связи эти электроны находятся вблизи соединенных атомов и прочно с ними связаны, тогда как при металлической связи электроны свободно перемещаются по всему кристаллу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической – пластичны, т. е. без разрушения изменяют форму, прокатываются в листы, вытягиваются в проволоку. Наличие свободных электронов придает кристаллам металлов непрозрачность, высокую электрическую проводимость, теплопроводность.
Иногда в соединениях мы встречаемся с особой формой химической связи – так называемой водородной связью. Она менее прочна, чем уже рассмотренные виды, и может считаться дополнительной связью к уже существующим ковалентным.
Водородная связь возникает между атомом водорода в соединении и сильно электроотрицательным элементом с малыми размерами - фтором, кислородом, азотом, реже хлором и серой.
Водородную связь обозначают точками, подчёркивая тем самым её сравнительную слабость (примерно в $$ 15–20$$ раз слабее ковалентной).
Водородная связь весьма распространена и играет важную роль при ассоциации молекул, в процессах кристаллизации, растворения, образования кристаллогидратов, электролитической диссоциации и других важных физико-химических процессах.
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары:
Эта способность обусловливает строение и свойства воды и льда.
Вода является жидкостью, хотя более тяжелый сероводород - полный электронный аналог воды - газ. Молекулы воды образуют между собой водородные связи, что увеличивает плотность вещества в жидком состоянии и его температуру кипения. Между молекулами сероводорода подобных связей не возникает из-за большого радиуса и сравнительно малой электро-отрицательности атома серы.
При замерзании количество водородных связей между молекулами воды становится максимальным. Строго ориентируясь относительно друг друга, они образуют правильные шестиугольники. Образованные ими канальцы заполнены воздухом, поэтому плотность льда меньше плотности воды (рис. 7).
Водородная связь приводит к образованию димеров муравьиной и уксусной кислот, устойчивых в газообразном и жидком состоянии:
Благодаря водородной связи фтороводород `"HF"` в обычных условиях суще-ствует в жидком состоянии (`"t"_"кип"=19,5^@"C"`), а плавиковая кислота диссоциирует с образованием как фторид-аниона `"F"^−`, так и гидродифторид-аниона $$ {\mathrm{HF}}_{2}^{-}$$.
Важную роль играют водородные связи в химии процессов жизнедеятельности, поскольку они распространены в молекулах белков, нуклеиновых кислот и других биологически важных соединений.

Одним из важнейших свойств ковалентной связи является её направленность. Она определяет пространственную структуру молекул. Если в молекуле имеется больше одной ковалентной связи, то двухэлектронные облака связей вступают во взаимодействие друг с другом. Представляя собой заряды одного знака, они отталкиваются друг от друга, стремясь занять такое положение в пространстве, когда их взаимное отталкивание будет минимальным. Если в первом приближении считать отталкивание всех облаков одинаковым, то в зависимости от числа взаимодействующих облаков (связей) наиболее выгодным расположением будет:
для `2` облаков - линейное расположение,
для `3` облаков - плоский треугольник,
для `4` облаков - тетраэдр,
для `5` облаков - тригональная бипирамида,
для `6` облаков - октаэдр.
Это наиболее распространенные геометрические формы многоатомных молекул (рис. 8).
Часто в образовании связей участвуют различные электроны, например `s` и `p`-электроны. Казалось бы, образующиеся связи тоже должны быть неравноценными. Однако опыт показывает, что все связи одинаковы. Теоретическое обоснование этого факта было предложено Слейтером и Полингом, которые ввели понятие гибридизации атомных орбиталей. Они показали, что при участии в образовании связей нескольких различных орбиталей, незначительно отличающихся по энергии, можно заменить их тем же количеством одинаковых орбиталей, называемых гибридными. При этом орбитали смешиваются и выравниваются по энергии. Изменяется и первона-чальная форма электронных облаков: гибридные орбитали асимметричны и сильно вытянуты по одну сторону от ядра.
Если гибридизуются две орбитали - `s`- и `p`- - тип гибридизации так и называется: `sp`-гибридизация. Он реализуется, например, в молекуле $$ {\mathrm{BeCl}}_{2}$$:
В этом соединении атому бериллия нужно образовать две связи с атомами хлора. Он переходит в возбужденное состояние и его электронная пара, находящаяся на `2s`-орбитали, распаривается:
Орбитали, занятые валентными электронами, гибридизуются по типу `sp`-гибридизации, в результате чего изменяется их первоначальная форма, они становятся одинаковыми как по форме, так и по энергии, и в таком состоянии способны образовывать более прочные связи за счёт наиболее полного перекрывания с `p`-орбиталями атомов хлора:
Таким образом, геометрия этой молекулы - линейная, валентный угол связи `180^@`.
Однако нужно отметить, что для данного соединения употреблять термин «молекула» можно только тогда, когда хлорид бериллия находится в газообразном состоянии.
Рассмотрим пример `sp^2`-гибридизации. При образовании молекулы хлорида бора $$ {\mathrm{BCl}}_{3}$$ в результате возбуждения `2s`-электронов атома бора три орбитали смешиваются (гибридизируются) с образованием трёх одинаковых `sp^2`-гибридных орбиталей, которые и образуют три связи с валентными электронами трёх атомов хлора.
`s+p+p->3sp^2`
`3sp^2("B")+p("Cl")+p("Cl")+p("Cl")->3` ковалентные связи `"B"-"Cl"`.
Поскольку три гибридные $$ s{p}^{2}$$-орбитали расположены под углом `120^@` друг к другу в одной плоскости, то образующаяся молекула $$ {\mathrm{BCl}}_{3}$$ имеет вид плоского равностороннего треугольника с атомом `"B"` в центре. Угол между связями составляет `120^@`, все атомы лежат в одной плоскости (рис. 9).
Четыре $$ s{p}^{3}$$-гибридных облака определят тетраэдрическое строение молекулы с валентными углами `109,5^@`, например в молекуле метана $$ {\mathrm{CH}}_{4}$$ (рис.10).
Существуют и другие виды гибридизации, в частности, с участием `d`-электронов. Например, $$ s{p}^{3}d$$-гибридизация приводит к структуре тригональной бипирамиды, а $$ s{p}^{3}{d}^{2}$$-гибридизация формирует октаэдрическую структуру молекулы.

Для химической характеристики вещества наиболее важны его кислотно-основные и окислительно-восстановительные свойства. Они напрямую связаны со строением молекулы.
Способность молекулы вступать в кислотно-основные реакции, т. е. проявлять свойства кислоты или основания, также зависит от полярности связи. Например, если рассматривать вещества, образующие связи $$ \mathrm{R} –\mathrm{O} –\mathrm{H}$$, можно проследить влияние заместителя `"R"` на свойства группы $$ \mathrm{O}–\mathrm{H}$$. По мере роста полярности связи $$ \mathrm{R}-\mathrm{O}$$ в ряду $$ \mathrm{N}–\mathrm{O}$$, $$ \mathrm{Zn}–\mathrm{O}$$, $$ \mathrm{Na}–\mathrm{O}$$ прочность её ослабевает, поэтому усиливаются основные свойства и снижаются кислотные свойства соединений: сравните $$ {\mathrm{O}}_{2}\mathrm{NOH}$$ (сильная азотная кислота, так как связь $$ \mathrm{N}-\mathrm{O}$$ менее полярна, чем $$ \mathrm{H}-\mathrm{O}$$) – $$ \mathrm{Zn}(\mathrm{OH}{)}_{2}$$ (это амфотерное соединение, поскольку связи $$ \mathrm{O}–\mathrm{H}$$ и $$ \mathrm{Zn}–\mathrm{O}$$ близки по полярности) - $$ \mathrm{NaOH}$$ (сильное основание, так как связь $$ \mathrm{Na}-\mathrm{O}$$ полярнее, чем связь $$ \mathrm{O}-\mathrm{H}$$).
Наряду с полярностью связи реакционная способность зависит и от ее длины. Так, если рассмотреть однотипные соединения $$ \mathrm{R}-\mathrm{H}$$, где $$ \mathrm{R}$$ - атом галогена, то в ряду $$ \mathrm{HF}–\mathrm{HCl}–\mathrm{HBr}–\mathrm{HI}$$ растет размер атома галогена и ослабляется его связь с атомом водорода, что проявляется в усилении кислотных свойств, т. е. способности отщеплять катион водорода $$ {\mathrm{H}}^{+}$$ при диссоциации в водном растворе.
Окислительно-восстановительная способность молекул, т. е. склонность их вступать в реакции, связанные с изменением степени окисления, также зависит от состояния атомов, образующих молекулы. Атомы, имеющие недостаток электронов (т. е. находящиеся в высшей положительной степени окисления), стремятся их приобрести, поэтому они будут проявлять окислительные свойства. Атомы, имеющие избыток электронов (т. е. находящиеся в низшей отрицательной степени окисления), стремятся их отдать, поэтому они будут проявлять восстановительные свойства.
В зависимости от степени окисления входящих в соединение атомов будет изменяться заполнение их электронных оболочек. Поэтому в разных степенях окисления один и тот же атом может проявлять свойства окислителя или восстановителя. Например, марганец в степени окисления $$ +7$$ является сильным окислителем, а в степени окисления $$ +2$$ - восстановителем.
Геометрия молекул также оказывает влияние на реакционную способность отдельных атомов или групп атомов. Ее учёт необходим при рассмотрении свойств сложных молекул, в которых определенные группы атомов могут затруднять приближение реагирующих молекул к атомам, расположенным ближе к центру молекулы.
Таким образом, строение электронной оболочки атома предопределяет возможность образования им химических связей и свойства этих связей, т. е. химические свойства образовавшегося соединения. Но строение электронной оболочки зависит от положения атома в периодической таблице элементов. Поэтому между положением элемента в Периодической системе и химическими свойствами его соединений прослеживается четкая связь.
Положение элемента в периодической системе (номер группы и периода) позволяет оценить число валентных электронов, способных принимать участие в образовании химических связей. Степень завершённости внешнего энергетического уровня позволяет предсказать склонность атома к присоединению или отдаче электронов. Таким образом, возможно предвидеть как максимальную валентность данного элемента, так и наиболее характерные степени окисления его в соединениях и, следовательно, характерные формулы соединений. Анализ степени ионности образующихся связей с другими элементами позволяет предсказывать химическое поведение этих соединений.
Возьмём для примера элемент №`15` - фосфор и попытаемся предсказать свойства его соединений исходя из его положения в периодической системе. Этот элемент находится в главной подгруппе $$ \mathrm{V}$$ группы и в `3` периоде. Конфигурация внешнего электронного слоя $$ 3{s}^{2}3{p}^{3}$$, т. е. фосфор имеет `5` валентных электронов. Число недостающих до завершения внешнего уровня электронов $$ \left(3\right)$$ меньше, чем число электронов, которые необходимо отдать, чтобы освободить внешний уровень $$ \left(5\right)$$. Поэтому атом фосфора будет охотнее принимать недостающие электроны, т. е. проявлять окислительную способность (неметаллические свойства).
Наиболее устойчивыми будут соединения со степенью окисления фосфора $$ –3$$, в которых атом фосфора, приняв `3` электрона от партнеров по связям, завершит свой внешний уровень. Отрицательные степени окисления будут иметь соединения фосфора с менее электроотрицательными элементами: водородом и металлами. В степени окисления $$ –3$$ фосфор образует летучее водородное соединение формулы $$ {\mathrm{PH}}_{3}$$, которая характерна для элементов главной подгруппы $$ \mathrm{V}$$ группы. Разница электроотрицательностей фосфора и водорода невелика, поэтому в этом соединении будут слабополярные ковалентные связи, для которых нехарактерен разрыв с отщеплением катиона $$ {\mathrm{H}}^{+}$$, т. е. водные растворы этого соединения не будут проявлять свойства кислоты.
В то же время при взаимодействии фосфора с более электроотрицательными элементами (галогенами, кислородом) он будет отдавать свои валентные электроны, приобретая положительные степени окисления. Фосфор имеет возможность распарить свои `2s`-электроны, поскольку на `3` энергетическом уровне есть свободные орбитали `d`-подуровня. Возбужденный атом фосфора имеет `5` неспаренных электронов и может образовать `5` ковалентных связей с более электроотрицательными атомами, т. е. его максимальная валентность равна `5`. Наиболее устойчивыми будут соединения в степенях окисления $$ +3$$ и $$ +5$$; они образуются при отдаче `3p`-электронов или всех `5` валентных электронов. В положительных степенях окисления фосфор будет образовывать оксиды $$ {\mathrm{P}}_{2}{\mathrm{O}}_{3}$$ и $$ {\mathrm{P}}_{2}{\mathrm{O}}_{5}$$. С водой эти оксиды дают соединения $$ {\mathrm{H}}_{3}{\mathrm{PO}}_{3}$$ и $$ {\mathrm{H}}_{3}{\mathrm{PO}}_{4}$$. Поскольку разница относительных электроотрицательностей `"O"` и `"H"` чем `"O"` и `"P"`, то связь $$ \mathrm{O}-\mathrm{H}$$ более полярна, чем связь $$ \mathrm{O}-\mathrm{P}$$, поэтому она будет разрываться легче с образованием катиона $$ {\mathrm{H}}^{+}$$. Значит, эти соединения будут проявлять свойства кислот, а следовательно, и и сами оксиды будут кислотными оксидами.
Ввиду того, что фосфор занимает промежуточное положение между ярко выраженными металлами и неметаллами в ряду значений относительной электроотрицательности, для него нехарактерно образование ионных связей; связи его в соединениях неполярные или слабополярные ковалентные. На основании рассмотрения конкретных молекул можно определить их пространственную структуру.

Контрольные задания. Часть II Химическая связь
За каждый правильный ответ – 2 балла. Всего за задание 12 баллов.
1. С учётом одного из важнейших свойств ковалентной связи – насыщаемо-сти – предложите доводы, согласно которым существуют молекулы и , но не образуются и .
2.Какова стереометрия следующих гибритизаций орбиталий центрального атома Каким геометрическим формам соответствуют частицы с гибридизацией орбиталей центрального атома? Дайте про-странственное изображение этих форм.
3. Известно, что в атомах бериллия и бора 2р-орбитали расположены вдоль осей х, y, z с углами между ними по °. Почему молекула 1линейная (а не угловая), а плоская, а не пирамидальная?
4. Дайте полный ответ на вопрос: почему лёд замерзает на поверхности реки, а не около дна? В чем причина уникальных физических свойств воды?
5. Укажите, какая кристаллическая решётка (атомная, молекулярная, ион-ная, металлическая) реализуется у следующих веществ, находящихся в твёр-дом агрегатном состоянии?
6. Известно, что существуют молекулы и , однако ион есть, а - нет. Почему?

Из курса химии средней школы вы знаете, что атом состоит из ядра и электронной оболочки. Ядро состоит из нуклонов - протонов и нейтронов, электронная оболочка - из электронов. Эти частицы называются элементарными.
В целом атом электронейтрален, так как заряды ядра и электронной оболочки компенсируют друг друга: число протонов в ядре равно числу электронов в электронной оболочке.
Таблица 1. Основные характеристики элементарных частиц
|
Частица |
Символ |
Масса |
Заряд* |
|
|
кг |
а. е. м. |
|||
|
Электрон |
`e^-` |
`9,109*10^(-31)` |
`1//1837` |
`–1` |
|
Протон |
`p^+` |
`1,673*10^(-27)` |
`1` |
`+1` |
|
Нейтрон |
`n^0` |
`1,675*10^(-27)` |
`1` |
`0` |
* Величина заряда электрона и протона равна `1,60*10^(-19)` Кл.
Масса атома в основном сосредоточена в ядре и определяется суммой масс протонов и нейтронов, т. к. электроны из-за своей малой массы на эту величину практически не влияют.
Сумма масс протонов и нейтронов называется массовым числом. При обозначении элемента она ставится как левый верхний индекс: $$ {}_{7}{}^{14}\mathrm{N}$$.
важнейшая характеристика атома, лежащая в основе его современного определения.
В Периодической системе Д.И. Менделеева порядковый номер элемента определяется именно зарядом ядра.
При обозначении элемента он ставится как левый нижний индекс.
Атомы с одинаковым зарядом ядра могут иметь разное количество нейтронов, то есть разные массы. Разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разные массы, называют изотопами.
Изотопы одного и того же элемента имеют одинаковые химические свойства, так как масса атома не играет существенной роли непосредственно в формировании этих свойств.

Александр Михайлович Бутлеров - профессор Казанского университета, академик, создатель теории химического строения органических соединений. На основе этой теории предсказал и впервые синтезировал ряд новых соединений. Понятие «химическое строение» в теории является ключевым. А. М. Бутлеров определял «химичес-кое строение» как последовательность соединения атомов в молекуле.
Другим значимым аспектом теории А. М. Бутлерова стало утверждение, что химическое строение веществ можно установить опытным путём химическими методами и отразить в формуле.
отражены в следующем:
1. Атомы в молекулах соединены друг с другом в определённой последовательности согласно их валентности.
2. Свойства веществ зависят от вида и количества атомов, входящих в состав молекулы, а также от химического строения. Химическое строение определяет взаимное влияние атомов в молекуле.
3. Химическое строение молекулы может быть установлено в результате изучения свойств вещества.
Структуры органических соединений отображаются химическими формулами, в которых показан порядок соединения атомов в молекулах. Такие формулы называют формулами химического строения или структурными формулами.
Структурные формулы отображают только последовательность соединения атомов, но не расположение их в пространстве.
Каждая структурная формула отображает строение одной и той же молекулы пропана, т. к. последовательность соединения атомов в данном случае не изменяется.
Структурные формулы веществ обычно изображают в сокращённом виде `"CH"_3-"CH"_2-"CH"_3`. В сокращённых формулах чёрточки показывают связь атомов углерода друг с другом, но не показывают связи между атомами углерода и водорода. Начиная с бутана возможен различный порядок соединения атомов при одном и том же составе молекулы, т. е. в бутане атомы углерода могут располагаться в виде линейной и разветвлённой цепей.
`"C"-"C"-"C"-"C"`
В первом случае каждый атом углерода соединён с одним (если он концевой) или с двумя (если он находится внутри цепи) соседними атомами углерода; во втором случае – появляется атом углерода, соединённый с тремя соседними атомами углерода. Различному порядку связывания атомов при одном и том же качественном и количественном составе молекулы должны соответствовать разные вещества.
Бутан линейного строения и изобутан различаются температурами кипения.
| `"CH"_3-"CH"_2-"CH"_2-"CH"_3` | |
| бутан (т. кип. `-0,5^@"C"`) | изобутан (т. кип. `-11,7^@"C"`) |
называют вещества, которые имеют одинаковый состав молекулы, но различное химическое строение.
С увеличением числа атомов углерода в молекуле число возможных изомеров резко возрастает. Различия в химическом строении являются причиной проявления изомерами различных физико-химических свойств.
Теория А. М. Бутлерова завоевала признание. Значение теории химического строения А. М. Бутлерова можно сравнить с Периодическим законом и Периодической системой химических элементов Д. И. Менделеева.
Для изображения электронного строения молекул используются электронные формулы (структуры Льюиса, октетные формулы). При написании электронной формулы должно выполняться правило октета, согласно которому атом, участвуя в образовании химической связи (отдавая или принимая электроны), стремится приобрести электронную конфигурацию инертного газа - октет (восемь) валентных электронов. Исключение составляет атом водорода, для которого устойчивой является конфигурация гелия, т. е. два валентных электрона.
Общую пару электронов иногда обозначают чёрточкой, которая и символизирует внутримолекулярную химическую связь:

Атом состоит из положительно заряженного ядра и находящихся в его поле отрицательно заряженных электронов. Число электронов в атоме химического элемента равно положительному заряду ядра атома и порядковому номеру элемента в ПСХЭ.
Электроны в атомах могут располагаться на разных энергетических уровнях. Число энергетических уровней равно номеру периода, в котором находится элемент. Число электронов на внешнем (валентном) уровне атомов малых периодов равно номеру группы, в которой находится элемент.
Движущиеся электроны можно представить в виде электронного облака. Ближе к ядру оно относительно плотное. Область, в которой нахождение электрона наиболее вероятно, называют орбиталью.
Орбитали отличаются своей формой и размерами. Их обозначают латинскими буквами `s`, `p`, `d`, `f`. Каждая орбиталь характеризуется определённой энергией, и на ней не может быть более двух электронов. Орбитали `s`-типа имеет форму шара. Орбитали `p`-типа имеют форму объёмной восьмёрки (гантель); все три `p`-орбитали взаимно перпендикулярны и энергетически эквивалентны.
Атом углерода - основа органических соединений. Углерод - элемент `"IV"` группы ПСХЭ Д. И. Менделеева. У атома углерода имеется два `s`-электрона на первом энергетическом уровне и четыре электрона на втором (внешнем) энергетическом уровне. На валентном энергетическом уровне имеются два спаренных и два неспаренных электрона. Химическая связь между атомами осуществляется путём спаривания неспаренных электронов и образования общих электронных пар называется ковалентной связью.
Атом углерода в органических соединениях находится в возбуждённом состоянии и его валентность равна четырём. Каждый неспаренный электрон атома углерода спаривается с неспаренным электроном атома водорода. Таким образом, атом углерода образует четыре ковалентные связи.
Теория гибридизации атомных орбиталей была разработана американским учёным Л. Полингом.
| |
Предполагается, что при образовании химических связей орбитали всех валентных электронов атома углерода выравниваются и становятся одинаковыми. При этом все они принимают форму несимметричных, вытянутых в направлении к вершинам тетраэдра, объёмных восьмёрок, которые не имеют ничего общего как с `s`-, так и с `p`-орбиталями. Таким образом,
гибридизация представляет собой процесс выравнивания атомных орбиталей по форме и энергии.
Для атома углерода возможны три типа гибридизация (валентных состояния).
`sp^3`- Гибридизация - процесс смешения одной `s`- и трёх `p`-орбиталей. Все четыре гибридные орбитали ориентированы строго в пространстве под углом `109^@28^'` по осям тетраэдра. Состояние углеродного атома с `sp_3`-гибридными орбиталями характерно для предельных углеводородов - алканов.
Если химическая связь между атомами осуществляется одной парой электронов, то её называют простой (одинарной) или `sigma` (сигма) - связью. Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры атомов, называется `sigma` (сигма) - связью. На рисунке представлены различные типы перекрывания атомных орбиталей (`s-s`, `s-p`, `p-p`-перекрывание) при образовании `sigma`-связи:
Чем больше область перекрывания (более тёмная часть на рисунке), тем большая электронная плотность сосредоточена в пространстве между ядрами и тем сильнее они «стягиваются». Поэтому `sigma`-связь отличается большей прочностью.
`sp^2`-Гибридизация - смешение одной `s`- и двух `p`-орбиталей. Образующиеся три гибридные орбитали расположены в одной плоскости под углом `120^@` друг к другу. Такое состояние характерно для непредельных углеводородов ряда этилена - алкенов.
Таким образом, каждый атом углерода имеет по три гибридных электронных облака и по одному негибридному `p`-облаку. Гибридные электронные облака взаимно перекрываются и образуют между атомами углерода `sigma`-связь.
Двойная связь состоит из одной `sigma` и одной `pi` связей. `pi`-Связь образована перекрыванием двух негибридных `p`-орбиталей (по одной от каждого атома углерода), оси которых параллельны друг другу и расположены перпендикулярно плоскости `sigma`-связей.
Особый интерес представляют диеновые углеводороды, в которых содержатся две двойные связи, разделённые одной одинарной связью. Такие алкадиены называются сопряжёнными. Все четыре атомы углерода, стоящие рядом в сопряжённой системе, находятся в состоянии `sp^2`-гибридизации:
$$ \underset{s{p}^{2}}{\stackrel{1}{\mathrm{C}}{\mathrm{H}}_{2}}=\underset{s{p}^{2}}{\stackrel{2}{\mathrm{C}}\mathrm{H}}-\underset{s{p}^{2}}{\stackrel{3}{\mathrm{C}}\mathrm{H}}=\underset{s{p}^{2}}{\stackrel{4}{\mathrm{C}}\mathrm{H}}-\underset{s{p}^{3}}{{\mathrm{CH}}_{3}}$$
Все атомы углерода и водорода находятся в одной плоскости, а `p`-орбитали атомов углерода располагаются перпендикулярно этой плоскости. Боковое перекрывание `p`-орбиталей при образовании `pi`-связей происходит не только в положениях `1,2` и `3,4`, но и частично в положении `2,3`. Таким образом, `pi`-связи в сопряжённых диенах являются делокализованными и образуют единую `pi`-систему. Делокализацию `pi`-связей в сопряжённых диенах изображают структурной формулой:
$$ {\mathrm{CH}}_{2}=\mathrm{CH}=\mathrm{CH}={\mathrm{CH}}_{2}$$
Связь `"C"_2-"C"_3` носит кратный характер. Это подтверждается экспериментальным определением длин связей. Показано, что в бутадиене-`1,3` длина связи `"C"_2-"C"_3` `(0,146 "нм")` несколько короче `sigma`-связей в алканах `(0,154 "нм")`, но длиннее двойной связи `(0,133 "нм")` в алкенах. А длина двойных связей в положениях `1` и `3` в бутадиене-`1,3` благодаря делокализации оказались несколько больше `(0,137 "нм")`, чем в алкенах. Особенности образования `sigma`- и `pi`-связей и являются причиной своеобразия химических свойств сопряжённых диеновых углеводородов.
| |
Другим соединением, в котором атом углерода находится в `sp^2`-гибридном состоянии, является бензол и его гомологи (ароматические соединения). Экспериментально установлено, что молекула бензола является плоской и все атомы углерода равнозначны, так же как и атомы водорода. Этот результат соответствует структурной формуле, предложенной Ф.А.Кекуле.
Было показано, что молекула бензола является правильным шестиугольником с одинаковыми расстояниями между ядрами атомов углерода `(0,140 "нм")`, что противоречит формуле Ф.А. Кекуле. Равенство межъядерных расстояний говорит о том, что в бензоле нет одинарных и двойных связей, т. к. в этом случае одни расстояния между центрами атомов углерода были бы примерно равны `0,154 "нм"`, а другие – `0,134 "нм"`.
Все атомы углерода в молекуле бензола находятся в состоянии `sp^2`-гибридизации. При этом гибридные электронные орбитали каждого атомы углерода образуют в плоскости кольца две `sigma`-связи с соседними атомами углерода и одну `sigma`-связь с атомом водорода, следовательно, углы между этими тремя связями равны `120^@`.
Каждая орбиталь взаимодействует путём бокового перекрывания с орбиталями обоих соседних с ним атомов углерода. Поэтому в молекуле образуется не три отдельные `pi`-связи, а единая `pi`-электронная система из шести `p`-электронов, общая для всех атомов углерода. Такое равномерное распределение электронной плотности приводит к усреднению длин связей между атомами углерода.
`sp`-Гибридизация – смешение одной `s`- и одной `p`-орбитали. Две гибридные орбитали расположены на одной оси (прямой) под углом `180^@` друг к другу. Остальные две негибридные орбитали расположены во взаимно перпендикулярных плоскостях. Состояние атома углерода с `sp`-гибридными орбиталями характерно для непредельных углеводородов с тройной связью – алкинов.
В случае, если происходит перекрывание четырёх негибридных атомных орбиталей (по две от каждого атома углерода), то возникает тройная связь. Тройная связь состоит из одной `sigma`- и двух `pi`-связей. `pi`-Связь менее прочная, чем `sigma`-связь, а её электроны легче смещаются в сторону одного из углеродных атомов.

определяется степенью смещения электронной плотности между атомами в молекуле. Поэтому ковалентная связь может быть неполярной (связь между атомами одного и того же химического элемента, например, `"H"-"H"`, `"C"-"C"`) и полярной (между атомами разных химических элементов (`"C"-"Cl"`, `"C"="O"` и др.) Образование полярных молекул связано с различной электроотрицательностью атомов, входящих в состав молекулы. Например, полярными являются молекулы хлороводорода и хлорметана. Большая электроотрицательность атома хлора приводит к смещению общей электронной пары к атому хлора, возникновению на нем частично отрицательного заряда (дельта минус), а на атомах углерода и водорода появляется недостаток электронной плотности и возникает частично положительный заряд (дельта плюс).
$$ \stackrel{\delta +}{\mathrm{H}}\rightarrow\stackrel{\delta -}{\mathrm{Cl}}$$ $$ \mathrm{C}{\stackrel{\delta +}{\mathrm{H}}}_{3}\rightarrow\stackrel{\delta -}{\mathrm{Cl}}$$
способность атома притягивать валентные электроны, участвующие в образовании связи: чем выше электроотрицательность, тем сильнее притяжение между ядром и валентными электронами. Атом углерода обладает различной электроотрицательностью. Это зависит от того, в каком валентном состоянии он находится. Поэтому электроотрицательность атома углерода изменяется в следующем ряду `"C"(sp)>"C"(sp^2)>"C"(sp^3)`. Ниже представлена таблица значений относительной электроотцательности атомов по Полингу.
способность изменять свою полярность под влиянием внешнего воздействия. При этом происходит смещение внешнего воздействия. Если полярность связи можно рассматривать как статическое явление, вызванное постоянным фактором различной электоорицательности связанных атомов, то поляризуемость – явление динамическое. При этом `pi`-связи поляризуются гораздо легче, чем `sigma`-связи.
определяется расстоянием между ядрами атомов и выражается в нанометрах `(1 "нм"=10^(-9) "м")`. Длина ковалентной связи зависит от её характера: чем больше кратность связи, тем она короче.
определяется энергией связи. Чем выше энергия связи, тем прочнее связь и тем труднее её разрушить.
Это означает, что образование ковалентной связи происходит не в любых направлениях пространства, а только в определённых. Углы, которые образуют между собой ковалентные связи, зависят от валентного состояния атома углерода.

связь, осуществляемая за счёт образования общих электронных пар, принадлежащих обоим атомам.
Существуют два механизма образования ковалентной связи: обменный и донорно-акцепторный.
При обменном механизме каждый из атомов отдаёт в общее пользование по одному неспаренному электрону. Таким образом построено большинство органических соединений (см. электронные формулы метана, этана, этена, ацетилена).
Ковалентная связь может быть образована также парой электронов, предоставляемой одним атомом, называемым донором электронов, и вакантной орбиталью другого атома, называемого акцептором электронов. Такой механизм образования ковалентной связи носит название донорно-акцепторным. Поясним механизм донорно-акцепторного взаимодействия на примере образовании хлорида метиламмония с помощью электронных формул (точками обозначены валентные электроны, а пустым квадратиком свободная `s`-орбиталь водорода):
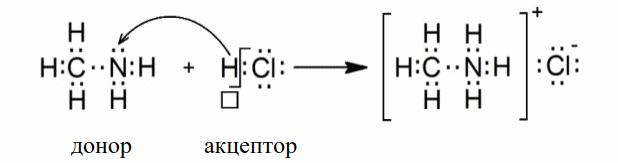
В ионе метиламмония все связи, образованные по двум различным механизмам, равноценны.

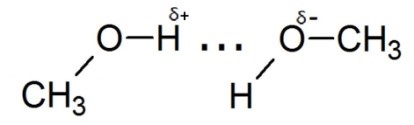
Существуют и межмолекулярные взаимодействия, например, водородная связь. Она возникает при взаимодействии атома водорода, соединённого с электроноакцепторными атомами `("N"`, `"O"`, `"F")` и не поделённой электронной парой другого атома или другой молекулы. Графически водородная связь изображается пунктиром.
Водородную связь образуют только такие атомы водорода, которые соединены с более электроотрицательным атомом, чем сам водород. При этом на атоме водорода создаётся частичный положительный заряд `delta^+`, а на более электроотрицательном атоме частично отрицательный заряд `delta^-`.
Например, для уксусной кислоты возникновение водородной связи может привести к объединению молекул в пары с образованием циклической димерной структуры, и молекулярная масса уксусной кислоты, измеренная по плотности пара, оказывается удвоенной:
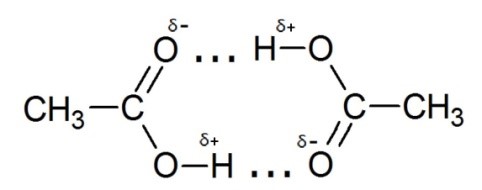
Межмолекулярные водородные связи влияют на многие физические свойства спиртов, кислот, производных аммиака. Они являются причиной образования вторичной структуры биологических полимеров - белков, нуклеиновых кислот.
Водородные связи чрезвычайно широко распространены в природе. Они обуславливают строение многих биологически важных молекул (белки, нуклеиновые кислоты). Относительная прочность водородных связей имеет свой биологический смысл: они являются достаточно прочными, чтобы выдерживать удары окружающих молекул, но способны разрываться при незначительных изменениях энергии сталкивающихся молекул.

Все органические соединения в зависимости от природы углеродного скелета можно разделить на ациклические и циклические.
называют также алифатическими. Они могут быть насыщенными (алканы и их производные) и ненасыщенными (алкены, алкадиены, алкины и их производные). Ациклические скелеты бывают неразветвленными (например, в н-гексане) и разветвленными (например, в `2,4`-диметилгексане):
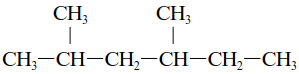 |
||
| н-гексан | 2,4-диметилгексан |
Среди циклических соединений обычно выделяют карбоциклические, молекулы которых содержат кольца из углеродных атомов, и гетероциклические, кольца которых содержат кроме углерода атомы других элементов (кислорода, серы, азота и др.).
Карбоциклические соединения подразделяются на алициклические (предельные и непредельные) и ароматические.
Примеры алициклических соединений:
 |
 |
 |
||
| циклобутан | циклогексан | циклогексен |
ароматических соединений:
 |
 |
|
||
| бензол | анилин | нафталин |
гетероциклических соединений:
 |
 |
 |
||
| фуран | пиридин | этиленоксид |
Рассмотренную классификацию органических соединений можно представить в виде краткой схемы:

В самих углеродных скелетах полезно классифицировать отдельные атомы углерода по числу химически связанных с ними атомов углерода. Если данный атом углерода связан с одним атомом углерода, то его называют первичным, с двумя - вторичным, тремя -третичным и четырьмя - четвертичным. Ниже показаны различные атомы углерода в разветвленном насыщенном углеводороде (алкане).
Обозначения: первичный (п), вторичный (в), третичный (т), четвертичный (ч) атомы углерода.
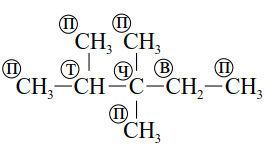
В состав многих органических соединений кроме углерода и водорода входят и другие элементы, причём в виде функциональных групп – групп атомов, определяющих химические свойства данного класса соединений. Некоторые наиболее характерные функциональные группы и соответствующие им классы соединений приведены в таблице:
|
Функциональная группа |
Название группы |
Классы соединений |
Примеры |
|
`-"F"`, `-"Cl"`, `-"Br"`, `-"I"` |
Галогены |
Галоген- производные |
`"CH"_3"Cl"` - хлорметан |
|
`-"OH"` |
Гидроксил |
Спирты |
`"C"_2"H"_5"OH"` - этиловый спирт |
|
Фенолы |
фенол |
||
|
|
Карбонил |
Альдегиды |
|
|
Кетоны |
ацетон |
||
|
|
Карбоксил |
Карбоновые кислоты |
уксусная кислота |
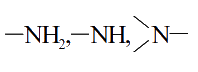 |
Аминогруппа |
Амины |
`"C"_2"H"_5"NH"_2`- этиламин |
|
`"CH"_3"NHCH"_3`- диметиламин |
|||
|
`-"NO"_2` |
Нитрогруппа |
Нитро- соединения |
`"CH"_3"NO"_2`- нитрометан |
Остановимся более подробно на некоторых из перечисленных классов органических соединений.
можно представить как продукты замещения атомов водорода в молекуле углеводорода гидроксильными группами `–"OH"`. Количество гидроксильных групп в молекуле определяет принадлежность спиртов к одноатомным, двухатомным, трехатомным и многоатомным.
Общая формула гомологического ряда предельных одноатомных спиртов - `"C"_n"H"_(2n+1)"OH"`.
называются продукты замещения в углеводородах атома водорода на ![]() группу, а кетоны содержат карбонильную группу
группу, а кетоны содержат карбонильную группу ![]() , связанную с двумя углеводородными радикалами `"R"`.
, связанную с двумя углеводородными радикалами `"R"`.
Общая формула альдегидов и кетонов `"C"_n"H"_(2n)"O"`.
вещества с общей формулой
Здесь `"R"` - атом `"H"` или углеводородный радикал: `"CH"_3`, `"C"_2"H"_5`, `"C"_3"H"_7` и т. п. Функциональная группа карбоновых кислот - карбоксильная группа:
Карбоновые кислоты с одной группой `"COOH"` в молекуле - одноосновные, с двумя группами `"COOH"` - двухосновные и т. д. В зависимости от природы радикала `"R"` различают предельные, непредельные и ароматические карбоновые кислоты.

Огромное разнообразие органических соединений выдвигает на первый план проблемы систематизации и классификации. Каждое органическое соединение должно быть названо, причём следует помнить, что ему можно было поставить в соответствие только одну структуру.
Номенклатура органических соединений правила, по которым образованы названия органических соединений.
В первоначальный период развития органической химии соединениям давали тривиальные названия. Тривиальная номенклатура - система исторически сложившихся названий, широко применяемых до настоящего времени. В основном эти названия даны в самый ранний период развития органической химии. Например, муравьиная кислота, уксусная кислота, ацетон, молочная кислота и т. д.
Важнейший принцип номенклатуры - однозначность, а именно: каждой структуре должно соответствовать единственное название, и наоборот, данному названию должна отвечать единственная структура.
Все органические соединения рассматриваются как производные углеводородов, в молекулах которых часть водородных атомов заменена на функциональные группы или углеводородные радикалы.
В настоящее время признана систематическая номенклатура ИЮПАК (IUPAC - Международный союз теоретической и прикладной химии). Для того, чтобы назвать органическое соединение по номенклатуре ИЮПАК, следует соблюдать
1. В молекуле выбирают наиболее длинную углеродную цепь (главную). Главная цепь содержит максимальное число функциональных групп. Название углеводорода, соответствующего главной цепи, и будет корнем составляемого названия.
2. Атомы углерода в главной цепи нумеруются таким образом, чтобы атом, к которому присоединён заместитель (углеводородный радикал или функциональная группа), получил меньший номер.
3. Перед корнем указывается положение заместителя цифрой и название заместителя. Если в молекуле несколько одинаковых заместителей, то используют приставки умножения: `2` - ди-, `3` - три-, `4` - тетра-, `5` - пента- и т. д. Если же в молекуле имеются разные заместители, их названия перечисляются в алфавитном порядке.
4. Органическое вещество причисляется к тому или иному классу в зависимости от того, какая функциональная группа присутствует в его молекуле. Если в соединении присутствует только одна функциональная группа, то она всегда обозначается суффиксом. Такая группа называется старшей (главной), и главную цепь выбирают таким образом, чтобы к ней обязательно была прикреплена основная группа. Если в соединении присутствуют несколько функциональных групп, то выбор и нумерацию главной цепи определяет старшая из них (старшинство группы тем выше, чем выше она расположена в нижеприведённой таблице):
|
Класс |
Функциональная группа |
приставка |
суффикс |
|
Карбоновые кислоты |
`-"COOH"` |
карбокси |
овая кислота |
|
Альдегиды |
`-"CHO"` |
оксо |
аль |
|
Кетоны |
`>"C"="O"` |
оксо |
он |
|
Спирты |
`-"OH"` |
гидрокси |
ол |
|
Амины |
`-"NH"_2` |
амино |
амин |
|
Галоидпроизводные |
`"F", "Cl", "Br", "I"` |
фтор, хлор, бром, иод |
фторид, хлорид, бромид, иодид |
|
Нитро- соединения |
`-"NO"_2` |
нитро |
- |
Остальные функциональные группы рассматривают как боковые заместители и обозначают в полном названии приставками (префиксами).
В данном примере корнем будет пент. Далее идут суффиксы -ан (насыщенное соединение) и -он (класс кетонов). Заместителями в молекуле являются две метильные группы в положениях `2` и `4` и бром в положении `1` (нумерация произведена так, чтобы положения заместителей обозначались возможно меньшими номерами). Старшей функциональной группой является карбонильная группа, расположенная у третьего атома углерода. Полное название соединения будет таким:
`1`-бром-`2,4`-диметилпентанон-`3`.
Соединение содержит `7` атомов углерода, его корень – гепт, далее идет суффикс -ен, указывающий на наличие ненасыщенности (двойной связи). Порядок нумерации обеспечивает старшей группе `–"OH"` наименьший номер. Полное название заканчивается суффиксом -ол, обозначающим старшую группу (суффикс -ол указывает на наличие гидроксильной группы). Положение двойной связи и гидроксильной группы указывается цифрами. Следовательно, приведённое соединение называется
гептен-`6`-ол-`2`.
В основе соединения `3` атома углерода, поэтому корень в названии проп, далее идут суффиксы -ан (насыщенное соединение) `+` -овая кислота (класс карбоновых кислот) При втором атоме углерода – метильная группа, полное название
`2`-метилпропановая кислота.
Многие соединения имеют устоявшиеся несистематические названия, такие, как глюкоза, муравьиная кислота, уксусная кислота, ацетон. Многие из этих так называемых тривиальных названий узаконены правилами ИЮПАК. Например, `2`-метилпропановая кислота называется изомасляной кислотой. В разделе «гомологические ряды органических соединений» тривиальные названия указаны в скобках.

До появления теории химического строения А. М. Бутлерова оставалось неизвестным существование веществ, которые имеют один и тот же состав и одну и ту же молекулярную массу, но различающиеся расположением атомов. Эти вещества обладали разными свойствами. Способность атомов углерода к образованию четырёх ковалентных связей, в том числе и с другими атомами углерода, открывает возможность существования нескольких соединений одного элементного состава. Такое явление было названо изомерией.
До создания теории химического строения было известно всего лишь одно вещество состава `"C"_4"H"_(10)` - бутан, который имеет линейное строение углеродной цепи. А. М. Бутлеров предположил возможность существования ещё одного вещества с такой же молекулярной формулой, но с другой последовательностью расположения атомов углерода в молекуле. Таким образом, был получен изомер бутана, который получил название изобутана (имеет разветвлённое строение).
Для пентана существует три изомера:
Температуры кипения бутана и пентана отличаются между собой, что служит доказательством того, что свойства соединений находятся в зависимости от строения их молекул.
это вещества, которые имеют одинаковую молекулярную формулу, но различное химическое строение (различные структурные формулы), а, следовательно, обладают различными свойствами.
В органической химии существует несколько типов изомерии. Самым простым является структурная изомерия.
называют изомеры, отвечающие различным структурным формулам органических соединений (с разным порядком соединений атомов).
В этом случае изомеры отличаются друг от друга только порядком связи между атомами в молекуле. Структурная изомерия имеет несколько разновидностей.
Изомерия углеродного скелета зависит от порядка соединения между собой атомов углерода в цепи (см. изомеры бутана и пентана).
Для правильного составления изомеров углеродного скелета необходимо соблюдать некоторые правила:
1. Записать углеродный скелет согласно числу атомов углерода.
$$ \stackrel{1}{\mathrm{C}}-\stackrel{2}{\mathrm{C}}-\stackrel{3}{\mathrm{C}}-\stackrel{4}{\mathrm{C}}-\stackrel{5}{\mathrm{C}}$$
2. Отрывают крайние атомы углерода (`"C"_1` или `"C"_5`) и располагают их у оставшихся в цепи атомов углерода, добиваясь максимально возможного числа перестановок. В результате чего первоначально записанный углеродный скелет укорачивается и принимает разветвлённое строение:
Следует иметь в виду, что произвольное укорачивание углеродной цепи исходного углеводорода не приводит к появлению нового изомера, а зачастую представляют собой одно и то же соединения.
Например, приведённые ниже формулы представляют собой вещество - пентан.
3. Соблюдая условие четырёхвалентности атомов углерода, необходимо заполнить оставшиеся валентности атомами водорода
(*н – означает углеводород нормального (неразветвленного) строения).
Другой разновидностью структурной изомерии является
Например, положения кратной связи:
| `"CH"_2="CH"-"CH"_2-"CH"="CH"_2` | `"CH"_2="CH"-"CH"="CH"-"CH"_3` | |
| пентадиен-1,4 | пентадиен-1,3 |
Или изомерия положения функциональной группы:
Если гидроксильных групп две, то число изомеров может также определяться взаимным расположением этих групп:
| `"HOCH"_2-"CH"_2-"CH"_2"OH"` | `"HOCH"_2-"CH"("OH")-"CH"_3` | |
| пропандиол-1,3 | пропандиол-1,2 |
Ещё одним видом изомерия является
Например, одной и той же молекулярной формуле `"C"_2"H"_6"O"` соответствуют два разных по строению вещества, относящиеся к различным классам органических соединений - этиловый спирт и диметиловый эфир.
| `"CH"_3-"CH"_2-"OH"` | `"CH"_3-"O"-"CH"_3` |
Различное расположение в соединении атомов между собой является причиной различных химических свойств этих соединений. Например, кислотные свойства проявляет только этанол при взаимодействии с металлическим натрием. Этиловый спирт - жидкость, диметиловый эфир - газообразное вещество.
Другим примером межклассовой изомерии являются карбоновые кислоты и сложные эфиры, например:
| `"CH"_3-"CH"_2"COOH"` | `"CH"_3-"COOCH"_3` | `"HCOOC"_2"H"_5` | ||
| Пропановая кислота | Метилацетат | Этилформиат |
Виды пространственной изомерии
называют соединения, имеющий одинаковый состав и одинаковый порядок соединения атомов, но отличающиеся расположением атомов в пространстве.
Геометрическая изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах часто возможно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости. Если изменение ориентации этих заместителей относительно плоскости возможно только за счёт разрыва одной из химических связей, то говорят о наличии геометрических изомеров.
|
цис-1,3-диметициклолгексан |
транс-1,2-дихлорциклогексан |
|
|
цис-бутен-2 |
транс-бутен-2 |
Оптическая изомерия возникает тогда, когда предмет - органическая молекула - несовместим со своим изображением в зеркале. Такое свойство обозначается термином «хиральность», а пространственные изомеры называются зеркальными, оптическими антиподами, или энантиомерами. В виде энантиомеров существует, например, молочная кислота `"CH"_3-"CH"("OH")-"COOH"`:
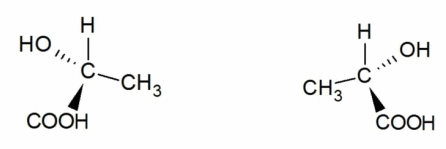
Энантиомеры имеют одинаковые температуры плавления и кипения, растворимость, показатель преломления и другие характеристики. Их отличия проявляются только при изучении вращения веществом плоскости поляризации света или при взаимодействии с другим хиральным соединением. Способность вращать плоскость поляризации света называется оптической активностью. Смесь равных количеств энантиомеров называется рацематом.

Органические реакции классифицируют по различным признакам:
Рассмотрим подробно каждую классификацию.
Радикальные реакции сопровождаются гомолитическим разрывом связей и образованием радикалов – нейтральных частиц, содержащих один или несколько неспаренных электронов:
Радикальные реакции распространены в превращениях алканов. Например, в хлорировании метана атом хлора выступает в роли радикального реагента, а реакция протекает как реакции радикального замещения и обозначается `"S"_"R"`.
Ионные реакции протекают с участием ионов и сопровождаются гетеролитическим разрывом связей в субстрате:
$$ \mathrm{R} \overline{):} \mathrm{X}\to \underset{\mathrm{карбокатион}}{{\mathrm{R}}^{+}}+\underset{\mathrm{анион}}{{\mathrm{X}}^{-}},$$
$$ \mathrm{R} \overline{):} \mathrm{X}\to \underset{\mathrm{карбанион}}{{\mathrm{R}}^{-}}+\underset{\mathrm{катион}}{{\mathrm{X}}^{+}}.$$
Заряженную частицу, имеющую вакантную `p`-орбиталь на атоме углерода, называют карбокатионом.
Заряженную частицу, имеющую НЭП на атоме углерода, называют карбанионом.
Ионные реакции чаще других встречаются среди превращений органических соединений:
$$ \underset{\mathrm{метиламин}}{{\mathrm{CH}}_{3}-\stackrel{··}{\mathrm{N}}{\mathrm{H}}_{2}}+\underset{\mathrm{хлороводород}}{\mathrm{HCl}}\underset{\mathrm{метиламмонийхлорид}}{\rightleftarrows \left[{\mathrm{CH}}_{3}-\stackrel{+}{\mathrm{N}}{\mathrm{H}}_{3}\right]{\mathrm{Cl}}^{-}}$$
$$ \underset{\mathrm{гидроксид}\text{-}\mathrm{ион}}{{\mathrm{HO}}^{-}}+\underset{\mathrm{хлорметан}}{\overset{\mathrm{\delta }+ }{{\mathrm{CH}}_{3}}}\to \stackrel{\mathrm{\delta }-}{\mathrm{Cl}}\to \underset{\mathrm{метанол}}{\mathrm{HO}-{\mathrm{CH}}_{3}}+\underset{\mathrm{хлорид}\text{-}\mathrm{ион}}{{\mathrm{Cl}}^{-}}$$.
Нейтральные молекулы или положительно заряженные реагенты, которые в ходе реакции принимают электронную пару для образования ковалентной связи с субстратом, называют электрофильными реагентами или электрофилами (например, `"R"^+`, `"Cl"^+`, `"NO"_2^+` и т. д.).
Нейтральные молекулы или отрицательно заряженные реагенты, которые в ходе реакции отдают свою электронную пару для образования связи с субстратом, называют нуклеофильными реагентами или нуклеофилами (например, `"OH"^-`, `"C"_2"H"_5"O"^-`, `"Br"^-` и т. д.).
|
Тип химического превращения |
Обозначения органических реакций |
||
|
Радикалы |
нуклеофилы |
электрофилы |
|
|
Замещение `("S")` |
`"S"_"R"` |
`"S"_"N"` |
`"S"_"E"` |
|
Присоединение `("A")` |
`"A"_"R"` |
`"A"_"N"` |
`"A"_"E"` |
1) Реакция замещения - реакция, в ходе которой атом водорода или функциональная группа в исходной органической молекуле замещается на какую-либо функциональную группу или атом водорода. Исходные вещества принято называть реагентами. Для удобства один из реагентов принято называть субстратом, а другой - атакующей частицей. Субстрат имеет более сложное строение, атакующий реагент часто имеет неорганическую природу.
Различают радикальные, нуклеофильные и электрофильные реакции замещения. Рассмотрим примеры.
Реакция электрофильного замещения `"H"^+` на `"NO"_2^+` в бензольном кольце `("S"_"E")`:
Реакция нуклеофильного замещения `"Cl"^-` на `"OH"^-` в галогенпроизводных алканах `("S"_"N")`:
Реакция радикального замещения в алканах `("S"_"R")`
2) Реакция присоединения `(А)` - реакция, в ходе которой реагент присоединяется по кратным связям `("C"="C", "C"="O", "C"="N")` молекулы субстрата.
`"CH"_2="CH"_2+"H"_2"O" -> "CH"_3-"CH"_2"OH"`
3) Реакция отщепления (элиминирования) `(Е)` - реакция, в ходе которой от субстрата отщепляется молекула или частица (вода, галогеноводород).
4) Перегруппировка - реакция, в ходе которой замещение, присоединение или отщепление сопровождается также и изменениями углеродного скелета молекулы. В некоторых случаях соответствующее превращение идёт без изменения молекулярной формулы и представляет собой изомеризацию.
5) Реакция полимеризации - химический процесс, в котором молекулы ненасыщенного углеводорода присоединяются одна к другой за счёт разрыва `pi`-связей и образования новых `sigma`-связей.
$$ \underset{\mathrm{мономер}}{n{\mathrm{CH}}_{2}={\mathrm{CH}}_{2}}\to \underset{\mathrm{полимер}}{\overline{)(}{\mathrm{CH}}_{2}-{\mathrm{CH}}_{2}{\overline{))}}_{n}}$$, где `n` - степень полимеризации.
Некаталические реакции не требуют присутствия катализатора. Эти реакции ускоряются только при повышении температуры, иногда их называют термическими.
Каталитическими называют реакции, протекание которых требует присутсвия катализатора.
Фотохимические реакции - реакци, которые активируют облучением. Такой способ активирования обозначают `hnu`.

Брутто-формула химического вещества – формула, дающая информацию о том, какие атомы и в каком количестве присутствуют в молекуле данного соединения:
С12Н22О11 С2Н2О4 С3Н9N
сахароза щавелевая кислота триэтиламин
Чаще брутто-формулы называют молекулярными. Они удобны для проведения расчетов, связанных с молярными массами веществ, однако химики всё же предпочитают при написании брутто-формул вносить минимальную информацию о структуре молекул:
C2H5OH HCOOH C6H5COONa
этанол муравьиная кислота бензоат натрия
Структурная формула описывает порядок соединения атомов в молекуле. Химические связи изображаются чёрточками. Связь между водородом и остальными атомами обычно не указывается. Для изображения циклических структур широко используются общепринятые символы:
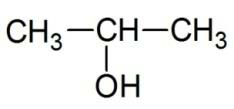 |
 |
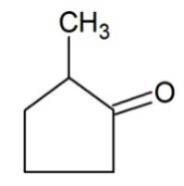 |
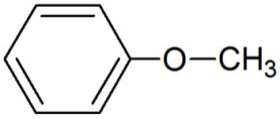
| пропанол-2 | метилфениловый эфир | 2-метилцикло-пентанон |
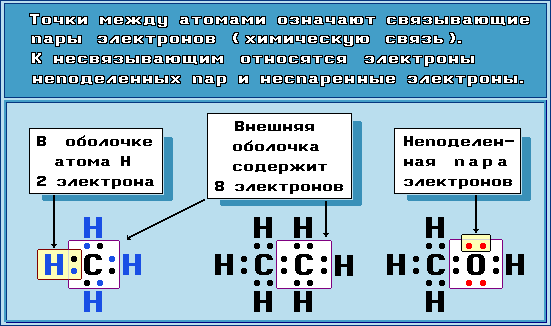
Для изображения электронного строения молекул используются электронные формулы (структуры Льюиса, октетные формулы). При написании электронной формулы должно выполняться правило октета, согласно которому атом, участвуя в образовании химической связи (отдавая или принимая электроны), стремится приобрести электронную конфигурацию инертного газа – октет (восемь) валентных электронов. Исключение составляет атом водорода, для которого устойчивой является конфигурация гелия, т. е. 2 валентных электрона.
Общую пару электронов иногда обозначают чёрточкой, которая и символизирует внутримолекулярную химическую связь.


Соединения, сходные по строению и химическим свойствам и отличающиеся друг от друга на гомологическую разность `"CH"_2` или в общем случае на `("CH"_2)_n`, называются гомологами и образуют единый гомологический ряд. Ниже приведены некоторые представители гомологического ряда алканов и предельных одноосновных карбоновых кислот, а также их общие формулы:
|
`"CH"_4` - метан `"C"_2"H"_6` - этан `"C"_3"H"_8` - пропан `"C"_4"H"_(10)` - бутан `"C"_5"H"_(12)` - пентан `"C"_6"H"_(14)` - гексан `bb("C"_n"H"_(2n+2))` |
`"HCOOH"` - метановая (муравьиная) кислота `"CH"_3"COOH"` - этановая (уксусная) кислота `"C"_2"H"_5"COOH"` - пропановая (пропионовая) кислота `"CH"_3("CH"_2)_2"COOH"` - бутановая (масляная) кислота `"CH"_3("CH"_2)_3"COOH"` - пентановая (валериановая) кислота `"CH"_3("CH"_2)_4"COOH"` - гексановая (капроновая) кислота `bb("C"_n"H"_(2n+1)"COOH")` |
Простейшие представители гомологического ряда алкенов - `"CH"_2="CH"_2` (этен), а алкинов - `"CH"-="CH"` (этин, ацетилен). Структурные формулы их ближайших гомологов вместе с общей формулой имеют вид:
|
`"CH"_2="CH"-"CH"_3` - пропен `"CH"_2="CH"-"CH"_2-"CH"_3` - бутен-`1` `"CH"_2="CH"-"CH"_2-"CH"_2-"CH"_3`-пентен-`1` `bb("C"_n"H"_(2n))` |
`"CH"-="C"-"CH"_3` - пропин `"CH"-="C"-"CH"_2-"CH"_3` - бутин-`1` `"CH"-="C"-"CH"_2-"CH"_2-"CH"_3` -пентин-`1` `bb("C"_n"H"_(2n-2))` |
Гомологический ряд бензола имеет общую формулу `"C"_n"H"_(2n-6)`. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например:
`"C"_6"H"_5"CH"_3`- метилбензол (толуол)
`"C"_6"H"_4("CH"_3)_2` - диметилбензол (ксилол)
`"C"_6"H"_5"C"_2"H"_5` - этилбензол
`"C"_6"H"_5"CH"("CH"_3)_2` - изопропилбензол (кумол)

Часто химические связи образуются за счёт электронов, расположенных на разных атомных орбиталях. Казалось бы, и связи в молекуле по прочности должны быть неравноценными. Однако опыт показывает, что они равнозначны. Это явление объясняется представлением о гибридизации атомных орбиталей, введённым американским химиком Л. Полингом.
Рассмотрим образование молекулы метана. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя р-электронами – 1s22s12p3. Экспериментальные данные показали, что все четыре связи С-Н в молекуле метана СН4 одинаковы и направлены к вершинам тетраэдра (угол между ними составляет 109о28').
Одинаковая прочность связей объясняется гибридизацией валентных (внешних) орбиталей, то есть смешением их и выравниванием по форме и энергии. При этом число гибридных орбиталей равно числу исходных.
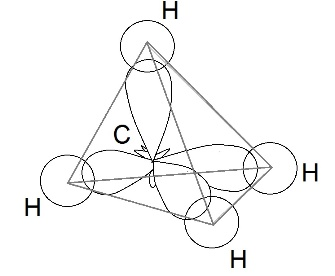 |
Четыре совершенно одинаковые sp3 –гибридные орбитали атома углерода расположены под углом 109о28' друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода. На рисунке видно, что гибридная орбиталь асимметрична и сильно вытянута по одну сторону от ядра.
Это обусловливает более сильное перекрывание гибридных орбиталей с орбиталями других атомов по сравнению с перекрыванием «обычных» s- и р-орбиталей и приводит к образованию более прочных связей.
Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры атомов, называется σ (сигма) – связью.
Так как гибридные электронные орбитали направлены к вершинам тетраэдра, то при образовании молекулы пропана С3Н8 направление химической связи между вторым и третьим атомами углерода не может совпадать с направлением связи между первым и вторым атомами углерода. Образуется угол 109о28'. Такие же углы существуют между четвертым, пятым и другими атомами углерода. Углеродная цепь принимает зигзагообразную форму:
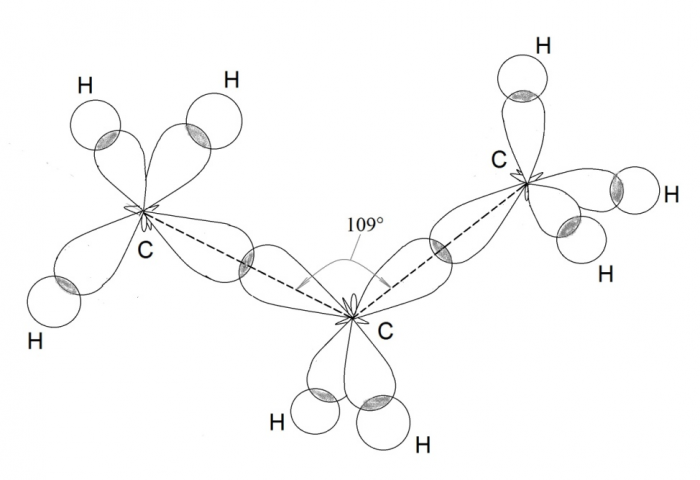
Ещё один вид гибридизации осуществляется в соединениях углерода ряда этилена. В этом случае происходит гибридизация одной s- и двух р-орбиталей углерода (sp2 –гибридизация). При этом образуются три одинаковые sp2 –гибридные орбитали, расположенные под углом 120о друг к другу. Таким образом каждый атом углерода имеет по три гибридных электронных облака и по одному негибридному р-облаку. Гибридные электронные облака взаимно перекрываются и образуют между атомами углерода σ –связь:
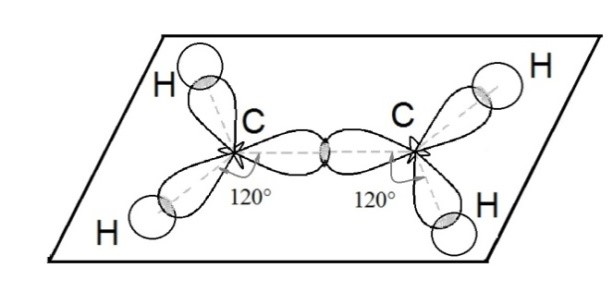
Остальные гибридные электронные облака атомов углерода перекрываются с s-облаками атомов водорода и также образуют σ -связи. Негибридные p-орбитали взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости σ-связей:
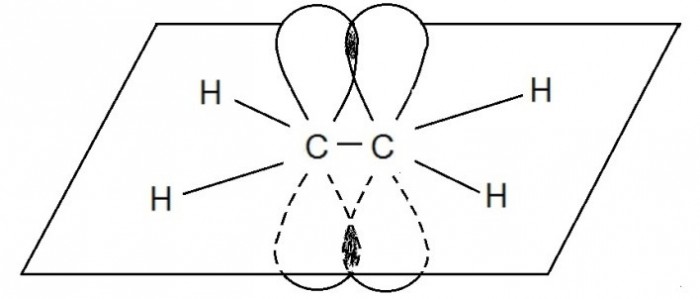
Ковалентная связь, возникающая при перекрывании орбиталей по обе стороны линии, связывающей центры атомов, называется π (пи) – связью.
Ещё одним примером, где происходит sp2 –гибридизации углерода, является молекула бензола. Три атомные орбитали (одна s и две р) каждого углерода в молекуле бензола гибридизируются и образуют три σ -связи. Гибридные орбитали перекрываются друг с другом. Перекрывание всех электронных облаков на одном рисунке показать трудно, поэтому рассмотрим последовательно два рисунка. Ниже приведены схема образования σ -связей в молекуле бензола:
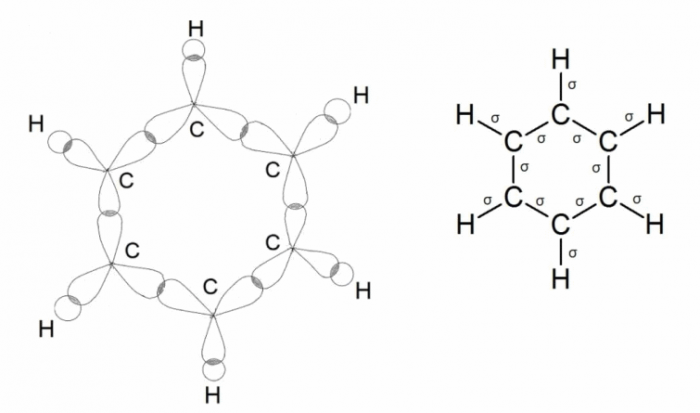
Негибридные р-электронные орбитали атомов углерода расположены перпендикулярно плоскости направления σ-связей, они также перекрываются друг с другом, образуя единую систему π-связей:
В молекуле ацетилена С2Н2 каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180о друг к другу. Они, как уже упоминалось выше, называются σ - связями.
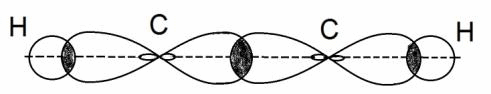
Но в молекуле ацетилена в каждом из атомов углерода содержится ещё по два p-электрона, которые не принимают участие в образование σ – связей. Молекула ацетилена имеет плоский линейный «скелет», поэтому оба р-электронных облака в каждом из атомов выступают из плоскости в перпендикулярном к ней направлении. При этом происходит некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании σ – связей. В итоге в молекуле ацетилена образуются ещё две ковалентные углерод-углеродные π-связи:
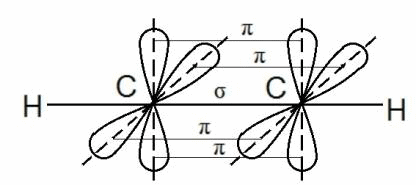
Под воздействием реагентов π-связь легко разрывается, она значительно слабее, чем σ–связь. π –связь образуется не только между атомами углерода, но и в случае образования двойных и тройных связей между углеродом и кислородом, углеродом и азотом.