 ЗФТШ
ЗФТШ
- Обучение
- Поступление в ЗФТШ
- О ЗФТШ
- Учителям
- Лекторий
-
Курсы
- Заочное отделение
- Очное отделение
- Факультативы
Органическое соединение массой $$ m=716 \mathrm{мг}$$, имеющее формулу $$ ({\mathrm{C}}_{3}{\mathrm{H}}_{6}\mathrm{O}{)}_{n}$$, при давлении $$ p={10}^{5} \mathrm{Па}$$ и температуре $$ t=200{}^{\circ }\mathrm{C}$$ занимает в газообразном состоянии объём $$ V=243 {\mathrm{см}}^{3}$$. Найдите $$ n$$.
Для молярной массы $$ M$$ этого соединения имеем:
,
где $$ {M}_{\mathrm{C}}=12 \mathrm{г}\mathrm{/}\mathrm{м}\mathrm{о}\mathrm{л}\mathrm{ь}$$, $$ {M}_{\mathrm{H}}=1 \mathrm{г}\mathrm{/}\mathrm{м}\mathrm{о}\mathrm{л}\mathrm{ь}$$ и $$ {M}_{\mathrm{O}}=16 \mathrm{г}\mathrm{/}\mathrm{м}\mathrm{о}\mathrm{л}\mathrm{ь} -$$ молярные массы углерода $$ \left(\mathrm{C}\right)$$, водорода $$ \left(\mathrm{H}\right)$$ и кислорода $$ \left(\mathrm{O}\right)$$, соответственно.
Подставляя выражение для $$ M$$ в уравнение состояния идеального газа, для $$ n$$ находим:
$$ n={\displaystyle \frac{mRT}{pV(3{M}_{\mathrm{C}}+6{M}_{\mathrm{H}}+{M}_{\mathrm{O}})}}=$$
$$ ={\displaystyle \frac{\mathrm{0,716}·{10}^{-3} \mathrm{кг}·\mathrm{8,31}\mathrm{Д}\mathrm{ж}/(\mathrm{м}\mathrm{о}\mathrm{л}\mathrm{ь}·\mathrm{K})·473 \mathrm{K}}{{10}^{5} \mathrm{Па}·\mathrm{0,243}·{10}^{-3} {\mathrm{м}}^{3}·58·{10}^{-3} \mathrm{к}\mathrm{г}/\mathrm{м}\mathrm{о}\mathrm{л}\mathrm{ь}}}=2$$.
Бутылка, наполненная воздухом, плотно закрыта пробкой площадью сечения `S=2,5 "см"^2`. До какой температуры `t_2` следует нагреть воздух, чтобы пробка вылетела из бутылки, если максимальная сила трения, удерживающая пробку, `F=12 "Н"`? Начальное давление воздуха в бутылке и наружное давление одинаковы и равны `p=100` кПа, начальная температура `t_1=-3^@"C"`.
В момент начала движения пробки разность сил давления, действующих на пробку, равна максимальной силе трения
.
Отсюда находим давление газа
в бутылке в этот момент. При изохорическом нагревании давление газа прямо пропорционально абсолютной температуре (закон Шарля)
.
Из приведенных соотношений приходим к ответу на вопрос задачи
`t_2=(t_1+273)(F/(pS)+1)-273~~127^@"C"`.
При нагревании идеального газа была получена зависимость давления от температуры, изображённая на рис. 7. Определите, что производилось во время нагревания газа: сжатие или расширение? абсолютная температура.
Для ответа на поставленный вопрос воспользуемся приёмом, основанном на вспомогательных построениях.
График изохорного процесса в координатах $$ p,T$$ представляет собой прямую линию, проходящую через начало координат. Угловой коэффициент этой прямой обратно пропорционально зависит от объёма.
Проведём две изохоры, одна из которых проходит через точку $$ 1$$, вторая – через $$ 2$$ (рис. 8). Первая изохора соответствует объёму $$ {V}_{1}$$ в состоянии $$ 1$$, вторая – объёму $$ {V}_{2}$$ в состоянии $$ 2$$. Видно, что первая изохора идёт круче второй, следовательно, её угловой коэффициент больше. Это, в свою очередь, означает, что $$ {V}_{1}<{V}_{2}$$ т. е. при переходе из состояния $$ 1$$ в состояние $$ 2$$ газ расширялся.
В вертикально расположенном цилиндре с гладкими стенками сечением $$ S$$ под поршнем массой $$ m$$ находится воздух при температуре $$ {T}_{1}$$. Когда на поршень положили груз массой $$ M$$, расстояние от него до дна цилиндра уменьшилось в $$ n$$ раз. На сколько повысилась температура воздуха в цилиндре? Атмосферное давление $$ {p}_{0}$$.
В первой ситуации на поршень действуют две силы, направленные вертикально вниз (сила тяжести $$ mg$$ и сила давления атмосферы $$ {p}_{0}S$$), и направленная вертикально вверх сила давления со стороны воздуха под поршнем $$ {p}_{1}S$$. Из равенства нулю равнодействующей этих сил (условие механического равновесия поршня) для начального давления $$ {p}_{1}$$ воздуха находим:
$$ {p}_{1}={p}_{0}+{\displaystyle \frac{mg}{S}}$$.
Рассуждая аналогичным образом, для давления $$ {p}_{2}$$ воздуха во второй ситуации (на поршень положили дополнительный груз массой $$ M$$) имеем:
$$ {p}_{2}={p}_{0}+{\displaystyle \frac{(m+M)g}{S}}$$.
Пусть $$ {H}_{1}$$ и расстояния от дна цилиндра до поршня в начале и в конце опыта. Тогда для начального $$ \left({V}_{1}\right)$$ и конечного $$ \left({V}_{2}\right)$$ объёмов воздуха можно записать: .
С учётом полученных соотношений уравнения Менделеева – Клапейрона для начального и конечного состояний воздуха принимают вид:
$$ {p}_{1}{V}_{1}=\left({p}_{0}+{\displaystyle \frac{mg}{S}}\right){H}_{1}S=\nu R{T}_{1}, {p}_{2}{V}_{2}=\left({p}_{0}+{\displaystyle \frac{(m+M)g}{S}}\right){H}_{2}S=\nu R{T}_{2}$$,
где число молей воздуха в цилиндре. Учитывая, что объём воздуха уменьшился в $$ n$$ раз $$ ({H}_{2}={H}_{1}/n)$$, для отношения температур воздуха находим:
$$ {\displaystyle \frac{{T}_{1}}{{T}_{2}}}={\displaystyle \frac{\left({p}_{0}+\frac{mg}{S}\right){H}_{1}S}{\left({p}_{0}+\frac{(m+M)g}{S}\right){H}_{2}S}}={\displaystyle \frac{n\left({p}_{0}+\frac{mg}{S}\right)}{\left({p}_{0}+\frac{(m+M)g}{S}\right)}}$$.
Теперь для изменения температуры $$ \Delta T={T}_{2}-{T}_{1}$$ получаем:
$$ \Delta T={T}_{1}\left({\displaystyle \frac{1}{n}}-1+{\displaystyle \frac{Mg}{n({p}_{0}S+mg)}}\right)$$.
Заметим, что воздух будет нагреваться, если выражение в скобках больше нуля.
$$ U$$-образная тонкая трубка постоянного внутреннего сечения с вертикально расположенными коленами заполняется ртутью так, что в каждом из открытых колен остаётся слой воздуха длиной (рис. 9). Затем правое колено закрывается небольшой пробкой. Какой максимальной длины слой ртути можно долить в левое колено, чтобы она не выливалась из трубки? Опыт производится при постоянной температуре, внешнее давление составляет $$ 720$$ мм рт. ст. (МФТИ, $$ 2000$$ г.)
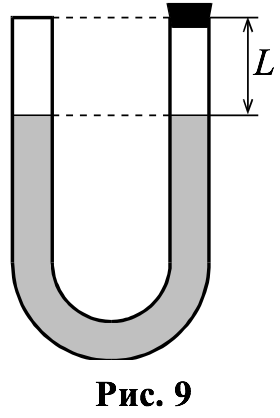 |
Пусть площадь сечения трубки. Тогда, после того как правое колено закрыли пробкой, между пробкой и ртутью оказался заперт воздух, занимающий объём $$ {V}_{1}=SL$$ при давлении $$ {p}_{1}=720$$ мм рт. ст. Равновесное состояние этого воздуха описывается уравнением Менделеева–Клапейрона , где – число молей воздуха, его температура.
При доливании в левое колено максимально возможного количества ртути оно будет заполнено ртутью полностью, т. е. уровень ртути поднялся на $$ L$$, а в правом колене уровень ртути поднимется на некоторую высоту $$ h$$. Таким образом, полная высота столбика ртути, долитой в трубку, равна $$ L+h$$.
Ртуть в трубке находится в равновесии. Условием равновесия является равенство давлений в точках, расположенных в правом и левом коленах на одном горизонтальном уровне. Выберем уровень, проходящий на расстоянии $$ L$$ от верхнего края трубки. Давление в левом колене $$ {p}_{\mathrm{л}}={p}_{1}+{\rho }_{\mathrm{рт}}gL$$, где $$ {p}_{1}$$ – атмосферное давление на открытую поверхность ртути.
Давление в правом колене $$ {p}_{\mathrm{п}}={p}_{2}+{\rho }_{\mathrm{рт}}gh$$, где $$ {p}_{2}$$ – давление воздуха, запертого в правом колене. Тогда условие равновесия ртути в трубке можно записать следующим образом:
$$ {p}_{\mathrm{л}}={p}_{1}+{\rho }_{\mathrm{рт}}gL={p}_{\mathrm{п}}={p}_{2}+{\rho }_{\mathrm{рт}}gh$$.
Новое равновесное состояние запертого в правом колене воздуха описывается уравнением:
.
Используя составленные соотношения, получаем квадратное уравнение для определения $$ h$$:
,
решая которое, находим: (второй корень уравнения не удовлетворяет условию задачи). Следовательно, в трубку можно долить слой ртути максимальной высотой .
Горизонтально расположенный сосуд постоянного внутреннего сечения и длины $$ L$$ разделён теплонепроницаемой подвижной перегородкой (рис. 10). В одной части сосуда находится азот, в другой гелий. В первоначальном состоянии температура газов $$ 300 \mathrm{К}$$, а объём, занимаемый гелием, в два раза больше объёма азота. Затем температуру азота повышают до $$ 600 \mathrm{К}$$. На какое расстояние переместится перегородка? Толщина перегородки много меньше $$ L$$. Трением между поршнем и стенками сосуда пренебречь.
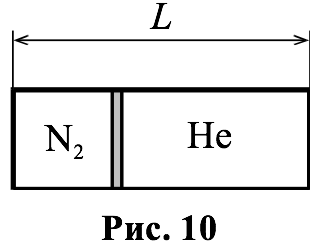 |
Найдём начальное положение перегородки $$ {l}_{1}$$ (отсчёт ведётся от левого края сосуда (см. рис. 10):
$$ {\displaystyle \frac{{V}_{{1}_{{\mathrm{N}}_{2}}}}{{V}_{{1}_{\mathrm{He}}}}}={\displaystyle \frac{S{l}_{1}}{S(L-{l}_{1})}}\Rightarrow {l}_{1}={\displaystyle \frac{{V}_{{1}_{{\mathrm{N}}_{2}}}/{V}_{{1}_{\mathrm{He}}}}{1+{V}_{{1}_{{\mathrm{N}}_{2}}}/{V}_{{1}_{\mathrm{He}}}}}L\Rightarrow {l}_{1}={\displaystyle \frac{1}{3}}L$$,
где $$ {V}_{{1}_{{\mathrm{N}}_{2}}}$$ и $$ {V}_{{1}_{\mathrm{He}}}$$ – начальные объёмы азота и гелия, $$ S$$ – площадь поперечного сечения сосуда.
Так как перегородка подвижна и теплонепроницаема, то давление в левой и правой частях сосуда будет одинаково, температура азота поднимется от $$ {T}_{1}$$ до $$ {T}_{2}$$ (по условию), а температура гелия остаётся неизменной $$ {T}_{1}$$.
Запишем уравнения Менделеева – Клапейрона для начального и конечного состояний, и найдём конечное отношение объёмов азота и гелия ( $$ {p}_{1}$$ и $$ {p}_{2}$$ – начальные и конечные давления в сосуде, $$ {\nu }_{{\mathrm{N}}_{2}}$$ и $$ {\nu }_{\mathrm{He}}$$ – количества азота и гелия, $$ {V}_{{2}_{{\mathrm{N}}_{2}}}$$ и $$ {V}_{{2}_{\mathrm{He}}}$$ – конечные объёмы азота и гелия).
В начальном состоянии:
$$ \left\{\begin{array}{lc}{p}_{1}{V}_{{1}_{{\mathrm{N}}_{2}}}& ={\nu }_{{\mathrm{N}}_{2}}R{T}_{1}\\ {p}_{1}{V}_{{1}_{\mathrm{He}}}& ={\nu }_{\mathrm{He}}R{T}_{1}\end{array}\right.\Rightarrow {\displaystyle \frac{{{\nu }_{\mathrm{N}}}_{2}}{{\nu }_{\mathrm{He}}}}={\displaystyle \frac{{V}_{{1}_{{\mathrm{N}}_{2}}}}{{V}_{{1}_{\mathrm{He}}}}}\Rightarrow {\displaystyle \frac{{\nu }_{{\mathrm{N}}_{2}}}{{\nu }_{\mathrm{He}}}}={\displaystyle \frac{1}{2}}$$
В конечном состоянии:
$$ \left\{\begin{array}{lc}{p}_{2}{V}_{{2}_{{\mathrm{N}}_{2}}}& ={\nu }_{{\mathrm{N}}_{2}}R{T}_{2}\\ {p}_{2}{V}_{{2}_{\mathrm{He}}}& ={\nu }_{\mathrm{He}}R{T}_{1}\end{array}\right.\Rightarrow {\displaystyle \frac{{V}_{{1}_{{\mathrm{N}}_{2}}}}{{V}_{{1}_{\mathrm{He}}}}}={\displaystyle \frac{{\nu }_{{\mathrm{N}}_{2}}}{{\nu }_{\mathrm{He}}}}·{\displaystyle \frac{{T}_{2}}{{T}_{1}}}\Rightarrow {\displaystyle \frac{{V}_{{1}_{{\mathrm{N}}_{2}}}}{{V}_{{1}_{\mathrm{He}}}}}={\displaystyle \frac{1}{2}}·{\displaystyle \frac{600 \mathrm{К}}{300 \mathrm{К}}}=1$$.
Конечное положение перегородки:
$$ {l}_{2}={\displaystyle \frac{{V}_{{2}_{{\mathrm{N}}_{2}}}/{V}_{{2}_{\mathrm{He}}}}{1+{V}_{{2}_{{\mathrm{N}}_{2}}}/{V}_{{2}_{\mathrm{He}}}}}L\Rightarrow {l}_{2}={\displaystyle \frac{1}{2}}L$$,
Смещение перегородки `Delta l`:
`Delta l = l_2 - l_1 =1/2 L -1/3 L =1/6 L`.
Итак, перегородка сместится на `1/6 L` вправо.
Воздушный шар, наполненный водородом $$ \left({\mathrm{H}}_{2}\right)$$ имеет объём $$ V=100 {\mathrm{м}}^{3}$$. Чему равна подъёмная сила шара у поверхности Земли? Давление и температура водорода и окружающего воздуха одинаковые и составляют соответственно $$ 760$$ мм рт. ст. и $$ 20{}^{\circ }\mathrm{C}$$. Оболочка шара тонкая и имеет массу $$ 9 \mathrm{кг}$$, молярная масса воздуха $$ {M}_{\mathrm{возд}}=29 \mathrm{к}\mathrm{г}\mathrm{/}\mathrm{м}\mathrm{о}\mathrm{л}\mathrm{ь}$$.
Подъёмная сила шара равна разности силы Архимеда (выталкивающей силы), действующей на аэростат со стороны окружающего его воздуха, и силы тяжести, действующей на оболочку шара и водород внутри него: $$ {F}_{\mathrm{под}}={F}_{\mathrm{арх}}-{F}_{\mathrm{тяж}}$$.
Для силы Архимеда имеем:
$$ {F}_{\mathrm{арх}}={\rho }_{\mathrm{возд}}gV,$$ где $$ {\rho }_{\mathrm{возд}}={\displaystyle \frac{p{M}_{\mathrm{возд}}}{RT}}$$.
Здесь $$ p -$$ давление воздуха, $$ {M}_{\mathrm{возд}}$$ – его молярная масса, $$ T$$ – температура. Учитывая уравнение состояния водорода, для силы тяжести, действующей на оболочку шара и водород, получаем:
$$ {F}_{\mathrm{тяж}}=(m+{m}_{\mathrm{вод}})g=(m+{\rho }_{\mathrm{вод}}V)g=\left(m+{\displaystyle \frac{p{M}_{\mathrm{вод}}V}{RT}}\right)g$$,
где $$ m$$ – масса оболочки, $$ {M}_{\mathrm{вод}}$$ – молярная масса водорода. Теперь для подъёмной силы находим:
$$ {F}_{\mathrm{под}}=\left({\displaystyle \frac{pV({M}_{\mathrm{возд}}-{M}_{\mathrm{вод}})}{RT}}-m\right)g\approx 1020 \mathrm{H}$$.
В баллоне находится смесь газов, содержащая $$ 524 \mathrm{г}$$ ксенона, $$ 16 \mathrm{г}$$ гелия и $$ 71 \mathrm{г}$$ молекулярного хлора $$ \left({\mathrm{Cl}}_{2}\right)$$. Найти молярную массу этой смеси.
По определению молярной массы:
$$ {M}_{\mathrm{смеси}}={\displaystyle \frac{{m}_{\mathrm{смеси}}}{{\nu }_{\mathrm{смеси}}}}={\displaystyle \frac{{m}_{\mathrm{Xe}}+{m}_{\mathrm{He}}+{m}_{{\mathrm{Cl}}_{2}}}{{\nu }_{\mathrm{Xe}}+{\nu }_{\mathrm{He}}+{\nu }_{{\mathrm{Cl}}_{2}}}}={\displaystyle \frac{{m}_{\mathrm{Xe}}+{m}_{\mathrm{He}}+{m}_{{\mathrm{Cl}}_{2}}}{\frac{{m}_{\mathrm{Xe}}}{{M}_{\mathrm{Xe}}}+\frac{{m}_{\mathrm{He}}}{{M}_{\mathrm{He}}}+\frac{{m}_{{\mathrm{Cl}}_{2}}}{{M}_{{\mathrm{Cl}}_{2}}}}}$$
$$ {M}_{\mathrm{смеси}}={\displaystyle \frac{524 \mathrm{г}+16 \mathrm{г}+71 \mathrm{г}}{\frac{524 \mathrm{г}}{131 \mathrm{г}\mathrm{/}\mathrm{м}\mathrm{о}\mathrm{л}\mathrm{ь}}+\frac{16 \mathrm{г}}{4 \mathrm{г}\mathrm{/}\mathrm{м}\mathrm{о}\mathrm{л}\mathrm{ь}}+\frac{71 \mathrm{г}}{71 \mathrm{г}\mathrm{/}\mathrm{м}\mathrm{о}\mathrm{л}\mathrm{ь}}}}\approx 68 \mathrm{г}\mathrm{/}\mathrm{м}\mathrm{о}\mathrm{л}\mathrm{ь}$$.
При изотермическом сжатии `18 "г"` водяного пара при температуре `T=373 "К"` его объём уменьшился в `4` раза, а давление возросло вдвое. Найти начальный объём пара.
При сжатии часть газа сконденсировалась, и оставшийся пар стал насыщенным. При температуре `T=373 "К"`, т. е. `100^@"C"`, его давление `p~~10^5 "Па"`. Уравнение Менделеева – Клапейрона для начального состояния `p/2V=m/muRT`, где `mu=18` `"г"//"моль"`.
Отсюда `V=(2mRT)/(mup)~~62*10^(-3) "м"^3=62 "л"`.