 ЗФТШ
ЗФТШ
- Обучение
- Поступление в ЗФТШ
- О ЗФТШ
- Учителям
- Лекторий
-
Курсы
- Заочное отделение
- Очное отделение
- Факультативы
5.1. Уравнение состояния идеального газа
Равенство коэффициента теплового расширения газа при постоянном давлении термическому коэффициенту давления при постоянном объёме является свойством, присущим только идеальным газам. Оно позволяет найти уравнение состояния газов.
Пусть газ совершает тепловой процесс, в котором его сначала нагревают при постоянном объёме, а затем при постоянном давлении. График процесса изохорического нагревания в координатах $$ p,V$$ изобразится прямой `1-2^'`, параллельной оси ординат $$ p$$ (рис. 6).
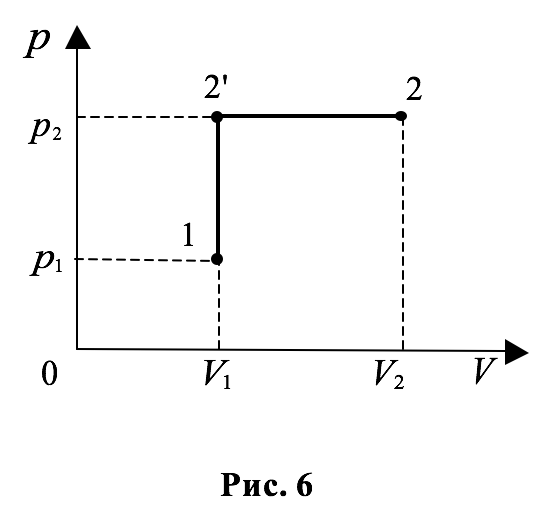 |
Процесс изобарического нагревания изобразится на этом графике прямой `2^'-2`, параллельной оси абсцисс $$ V$$.
Обозначим давление, объём и температуру газа в начале теплового процесса (точка $$ 1$$ на графике) как $$ {p}_{1},{V}_{1},{T}_{1}$$ соответственно; в конце процесса изохорического нагревания `p_2^'`, `V_2^'`, `T_2^'` (точка `2^'`) и в конце изобарического процесса $$ - {p}_{2},{V}_{2},{T}_{2}$$ (точка $$ 2$$).
Из закона Шарля следует, что отношение давления к абсолютной температуре есть величина постоянная: $$ p/T=\alpha {p}_{0}(\gamma =\alpha )$$. Поэтому давление и температура газа в точке `2^'` связаны с давлением и температурой газа в точке `1` соотношением `p_2^'//T_2^'=p_1//T_1`, из которого находим температуру `T_2^'` в конце изохорического нагревания:
`T_2^'=(p_2^')/p_1*T_1`.
Аналогично, используя закон Гей-Люссака, можно показать, что температура `T_2^'` и объём газа `V_2^'` в точке `2^'` в процессе изобарического нагревания связаны с температурой $$ {T}_{2}$$ и объёмом газа $$ {V}_{2}$$ в точке $$ 2$$ соотношением `V_2^'//T_2^'=V_2//T_2`. Подставляя в это уравнение температуру `T_2^'` и учитывая равенства `V_2^'=V_1`, `p_2^'=p_2`, получаем:
$$ {\displaystyle \frac{{V}_{1}{p}_{1}}{{p}_{2}{T}_{1}}}={\displaystyle \frac{{V}_{2}}{{T}_{2}}}$$.
Откуда следует:
$$ {\displaystyle \frac{{p}_{1}{V}_{1}}{{T}_{1}}}={\displaystyle \frac{{p}_{2}{V}_{2}}{{T}_{2}}}$$. (1)
Начальное и конечное состояния газа (точки $$ 1$$ и $$ 2$$) были выбраны совершенно произвольно. Можно было бы взять в качестве начального и конечного состояний другие точки. Процесс перевода газа из состояния $$ 1$$ в состояние $$ 2$$ также можно было бы совершить по-иному, нагревая, например, газ сначала изобарически, а затем изохорически. Однако в любом случае можно показать, что параметры начального (точка $$ 1$$) и конечного (точка $$ 2$$) состояний газа всегда связаны между собой соотношением (1), или, по-другому, что в состоянии теплового равновесия для данной массы газа справедливо соотношение:
$$ {\displaystyle \frac{pV}{T}}=\mathrm{const}$$. (2)
Неизвестную постоянную удалось вычислить после того, как итальянским физиком Авогадро был экспериментально установлен закон, согласно которому один моль любого газа при нормальных условиях, т. е. при нормальном атмосферном давлении $$ 1$$ атм $$ (101325 \mathrm{Па})$$ и температуре $$ 0{}^{\circ }\mathrm{C} (\mathrm{273,15} \mathrm{K})$$ занимает объём $$ \mathrm{22,4} \mathrm{л}$$. Подставляя эти данные в найденное соотношение (2), для моля газа получим значение постоянной $$ R$$:
$$ {\displaystyle \frac{pV}{T}}=R=8,31{\displaystyle \frac{\mathrm{Дж}}{\mathrm{моль}·\mathrm{K}}}$$.
Величину $$ R$$ называют универсальной газовой постоянной.
С учётом этого соотношения уравнение состояния для одного моля газа можно записать в виде:
$$ pV=RT$$. (3)
Используя уравнение (3), нетрудно получить уравнение состояния для произвольного количества газа. Так как в состоянии теплового равновесия масса газа распределена равномерно по объёму сосуда, то $$ \nu $$ молей газа при тех же условиях занимают в $$ \nu $$ раз больший объём, чем объём одного моля. Таким образом, уравнение состояния для $$ \nu $$ молей газа может быть записано в виде:
$$ pV=\nu RT={\displaystyle \frac{m}{M}}RT$$. (4)
Здесь $$ m$$ и $$ M -$$ масса и молярная масса газа. Уравнение называют уравнением состояния идеального газа.
Уравнение состояния в форме (2) было впервые записано Клапейроном, а в форме (4) – Менделеевым. Поэтому часто уравнение газового состояния называют уравнением (или законом) Менделеева – Клапейрона.
Следует отметить, что в реальных условиях ни один из газов не подчиняется строго уравнению Менделеева – Клапейрона. Правда, отклонения от закона Менделеева – Клапейрона фактически исчезают для достаточно разреженных газов. Однако при низких температурах и больших плотностях начинаются заметные отклонения от этого закона. Этот факт учитывается при графическом описании тепловых процессов с участием идеального газа. На рисунках 3-5 графики процессов изображаются сплошными линиями, которые нельзя продолжать в область низких температур. Пунктирная линия используется только в качестве вспомогательной.
Отклонения от закона Менделеева – Клапейрона наблюдаются и при достаточно высоких температурах (порядка тысячи или нескольких тысяч градусов) для газов из многоатомных молекул. При этих температурах начинается распад молекул на атомы (диссоциация). При ещё более высоких температурах начинается распад атомов на электроны и ионы, и любой газ перестаёт подчиняться уравнению Менделеева–Клапейрона, даже при сколь угодно малых плотностях.
В термодинамике идеальным называют газ, строго подчиняющийся уравнению Менделеева – Клапейрона (о том, что такое идеальный газ с точки зрения молекулярно-кинетической теории, см. в разделе 9 настоящего задания).
Из уравнения Менделеева – Клапейрона нетрудно получить зависимость между давлением $$ p$$, плотностью $$ \rho $$ и температурой $$ T$$ идеального газа:
`rho=m/V`, `rho=(pM)/(RT)`, `p=rho/MRT`. (5)