 ЗФТШ
ЗФТШ
- Обучение
- Поступление в ЗФТШ
- О ЗФТШ
- Учителям
- Лекторий
-
Курсы
- Заочное отделение
- Очное отделение
- Факультативы
Существуют и межмолекулярные взаимодействия, например, водородная связь. Она возникает при взаимодействии атома водорода, соединённого с электроноакцепторными атомами `("N"`, `"O"`, `"F")` и не поделённой электронной парой другого атома или другой молекулы. Графически водородная связь изображается пунктиром.
Водородную связь образуют только такие атомы водорода, которые соединены с более электроотрицательным атомом, чем сам водород. При этом на атоме водорода создаётся частичный положительный заряд `delta^+`, а на более электроотрицательном атоме частично отрицательный заряд `delta^-`.
Например, для уксусной кислоты возникновение водородной связи может привести к объединению молекул в пары с образованием циклической димерной структуры, и молекулярная масса уксусной кислоты, измеренная по плотности пара, оказывается удвоенной:
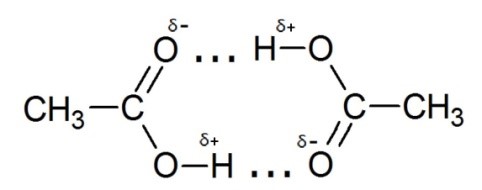
Межмолекулярные водородные связи влияют на многие физические свойства спиртов, кислот, производных аммиака. Они являются причиной образования вторичной структуры биологических полимеров - белков, нуклеиновых кислот.
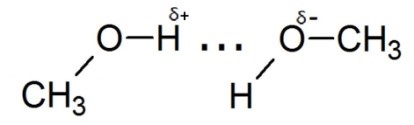
Водородные связи чрезвычайно широко распространены в природе. Они обуславливают строение многих биологически важных молекул (белки, нуклеиновые кислоты). Относительная прочность водородных связей имеет свой биологический смысл: они являются достаточно прочными, чтобы выдерживать удары окружающих молекул, но способны разрываться при незначительных изменениях энергии сталкивающихся молекул.