 ЗФТШ
ЗФТШ
- Обучение
- Поступление в ЗФТШ
- О ЗФТШ
- Учителям
- Лекторий
-
Курсы
- Заочное отделение
- Очное отделение
- Факультативы
До появления теории химического строения А. М. Бутлерова оставалось неизвестным существование веществ, которые имеют один и тот же состав и одну и ту же молекулярную массу, но различающиеся расположением атомов. Эти вещества обладали разными свойствами. Способность атомов углерода к образованию четырёх ковалентных связей, в том числе и с другими атомами углерода, открывает возможность существования нескольких соединений одного элементного состава. Такое явление было названо изомерией.
До создания теории химического строения было известно всего лишь одно вещество состава `"C"_4"H"_(10)` - бутан, который имеет линейное строение углеродной цепи. А. М. Бутлеров предположил возможность существования ещё одного вещества с такой же молекулярной формулой, но с другой последовательностью расположения атомов углерода в молекуле. Таким образом, был получен изомер бутана, который получил название изобутана (имеет разветвлённое строение).
Для пентана существует три изомера:
Температуры кипения бутана и пентана отличаются между собой, что служит доказательством того, что свойства соединений находятся в зависимости от строения их молекул.
это вещества, которые имеют одинаковую молекулярную формулу, но различное химическое строение (различные структурные формулы), а, следовательно, обладают различными свойствами.
В органической химии существует несколько типов изомерии. Самым простым является структурная изомерия.
называют изомеры, отвечающие различным структурным формулам органических соединений (с разным порядком соединений атомов).
В этом случае изомеры отличаются друг от друга только порядком связи между атомами в молекуле. Структурная изомерия имеет несколько разновидностей.
Изомерия углеродного скелета зависит от порядка соединения между собой атомов углерода в цепи (см. изомеры бутана и пентана).
Для правильного составления изомеров углеродного скелета необходимо соблюдать некоторые правила:
1. Записать углеродный скелет согласно числу атомов углерода.
$$ \stackrel{1}{\mathrm{C}}-\stackrel{2}{\mathrm{C}}-\stackrel{3}{\mathrm{C}}-\stackrel{4}{\mathrm{C}}-\stackrel{5}{\mathrm{C}}$$
2. Отрывают крайние атомы углерода (`"C"_1` или `"C"_5`) и располагают их у оставшихся в цепи атомов углерода, добиваясь максимально возможного числа перестановок. В результате чего первоначально записанный углеродный скелет укорачивается и принимает разветвлённое строение:
Следует иметь в виду, что произвольное укорачивание углеродной цепи исходного углеводорода не приводит к появлению нового изомера, а зачастую представляют собой одно и то же соединения.
Например, приведённые ниже формулы представляют собой вещество - пентан.
3. Соблюдая условие четырёхвалентности атомов углерода, необходимо заполнить оставшиеся валентности атомами водорода
(*н – означает углеводород нормального (неразветвленного) строения).
Другой разновидностью структурной изомерии является
Например, положения кратной связи:
| `"CH"_2="CH"-"CH"_2-"CH"="CH"_2` | `"CH"_2="CH"-"CH"="CH"-"CH"_3` | |
| пентадиен-1,4 | пентадиен-1,3 |
Или изомерия положения функциональной группы:
Если гидроксильных групп две, то число изомеров может также определяться взаимным расположением этих групп:
| `"HOCH"_2-"CH"_2-"CH"_2"OH"` | `"HOCH"_2-"CH"("OH")-"CH"_3` | |
| пропандиол-1,3 | пропандиол-1,2 |
Ещё одним видом изомерия является
Например, одной и той же молекулярной формуле `"C"_2"H"_6"O"` соответствуют два разных по строению вещества, относящиеся к различным классам органических соединений - этиловый спирт и диметиловый эфир.
| `"CH"_3-"CH"_2-"OH"` | `"CH"_3-"O"-"CH"_3` |
Различное расположение в соединении атомов между собой является причиной различных химических свойств этих соединений. Например, кислотные свойства проявляет только этанол при взаимодействии с металлическим натрием. Этиловый спирт - жидкость, диметиловый эфир - газообразное вещество.
Другим примером межклассовой изомерии являются карбоновые кислоты и сложные эфиры, например:
| `"CH"_3-"CH"_2"COOH"` | `"CH"_3-"COOCH"_3` | `"HCOOC"_2"H"_5` | ||
| Пропановая кислота | Метилацетат | Этилформиат |
Виды пространственной изомерии
называют соединения, имеющий одинаковый состав и одинаковый порядок соединения атомов, но отличающиеся расположением атомов в пространстве.
Геометрическая изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах часто возможно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости. Если изменение ориентации этих заместителей относительно плоскости возможно только за счёт разрыва одной из химических связей, то говорят о наличии геометрических изомеров.
|
цис-1,3-диметициклолгексан |
транс-1,2-дихлорциклогексан |
|
|
цис-бутен-2 |
транс-бутен-2 |
Оптическая изомерия возникает тогда, когда предмет - органическая молекула - несовместим со своим изображением в зеркале. Такое свойство обозначается термином «хиральность», а пространственные изомеры называются зеркальными, оптическими антиподами, или энантиомерами. В виде энантиомеров существует, например, молочная кислота `"CH"_3-"CH"("OH")-"COOH"`:
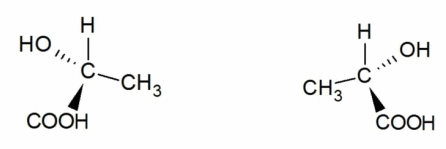
Энантиомеры имеют одинаковые температуры плавления и кипения, растворимость, показатель преломления и другие характеристики. Их отличия проявляются только при изучении вращения веществом плоскости поляризации света или при взаимодействии с другим хиральным соединением. Способность вращать плоскость поляризации света называется оптической активностью. Смесь равных количеств энантиомеров называется рацематом.